
科目: 来源: 题型:
【题目】进行化学实验时应强化安全意识。下列做法正确的是( )
A.金属钠着火时使用泡沫灭火器灭火
B.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
C.用试管加热碳酸氢钠固体时使试管口竖直向上
D.不慎将酒精灯碰翻,酒精在实验台上燃烧起来,应用湿抹布盖灭
查看答案和解析>>
科目: 来源: 题型:
【题目】将物质的量均为amol的Na 和Al一同投入mg足量水中,所得溶液的密度为ρg·cm-3,则此溶液的物质的量浓度为( )
A. 1000aρ/(46a+m)mol·L-1 B. 4ρ/(46a+m)mol·L-1
C. 1000aρ/(50a+m)mol·L-1 D. 1000aρ/(45a+m)mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
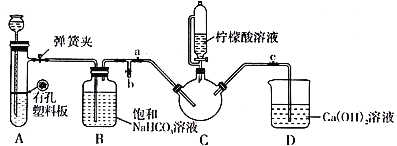
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(写化学式)。再滴加少量稀硫酸的作用是__________________________。
(2)实验II中:生成沉淀的离子方程式为__________________________。
(3)实验Ⅲ中:①C中盛柠檬酸溶液的仪器名称为___________________。
②装置A中所盛放的药品是___________________。(填序号)
A.Na2CO3和稀H2SO4 B.CaCO3和稀H2SO4 C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是____________________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是________________。
⑤洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A. 298K时,反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
B. 电解法精炼铜时,粗铜作阳极,精铜作阴极
C. 在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)
D. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是
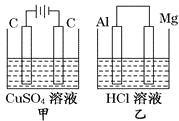
A. 溶液的质量变化:甲减小,乙增大
B. 溶液pH变化:甲减小,乙增大
C. 相同条件下产生气体的体积:V甲=V乙
D. 电极反应式:甲中阴极:Cu2++2e-==Cu,乙中负极:Mg-2e-==Mg2+
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香烃X,相对分子质量为92。以X为初始原料合成E,路线如下(部分产物和反应条件已略去)。

回答下列问题:
(1)有机物X的结构简式为_________________。
(2)A→B的反应条件为________________________________。
(3)C→D转化中①的化学方程式为________________________________。
(4)下列关于B的说法正确的是____________。
a.核磁共振氢谱有5个峰 b.能发生消去反应和还原反应
c.能与钠反应放出氢气 d.能和NaOH溶液反应
(5)E有多种同分异构体,同时符合下列条件的同分异构体共有_______种。
①遇NaHCO3溶液有气体放出 ②芳香族化合物
其中不含甲基的有机物的结构简式为_________。
(6)有机物X可通过三步合成W,W是高分子化合物 的单体。
的单体。
已知:Ⅰ.苯环上的甲基可以被酸性KMnO4氧化成羧基
Ⅱ.苯环侧链的硝基可被Fe/HCl还原为氨基,苯环侧链的氨基易被氧化

①F的结构简式为_______________,试剂a为_______________。
②在一定条件下W聚合成高分子化合物的化学方程式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
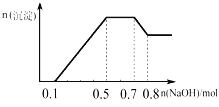
A. 溶液中的阳离子只有H+、Mg2+、Al3+
B. 溶液中一定不含CO32﹣,一定含有SO42﹣和NO3﹣
C. 溶液中n(NH4+)=0.25mol
D. 三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=2:2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。
N在元素周期表中的位置:______________。
元素C、N最简单气态氢化物的稳定性强弱比较(填化学式): ____________.
I.氨气应用于侯德榜制碱工艺,原理如下图所示:
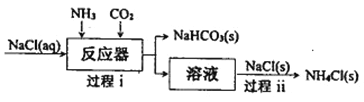
(1)过程i通入NH3和CO2的顺序是___________。
(2)过程ii有利于析出更多NH4Cl(s)的原因是_____________。
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)_________________。 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为____________。
Ⅱ.电镀工业中含CN-的废水在排放前的处理过程如下:
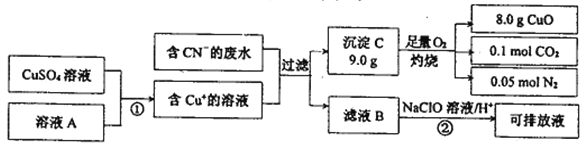
(1)溶液A具有的性质是(填“氧化性”或“还原性”) _______. C的化学式为:______。
(2)反应② 可将CN一转化为无害物质,其离子方程式为:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于钠的叙述中,正确的是( )
A.钠放在空气中易被氧气氧化为过氧化钠,因此应保存在水面下
B.钠是强还原剂,它能从溶液中置换出金属活动性顺序表中钠后面的金属
C.直接观察,钠的焰色反应呈黄色
D.金属钠着火时,能用水来灭火
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com