
科目: 来源: 题型:
【题目】下列有关用途叙述错误的是( )
A. 碘化银为黄色固体,可用作人工降雨
B. 钠钾合金常温下为液体,可做快中子反应堆的导热剂
C. 钠还原性强,可从氯化物溶液中置换出钛钽铌锆等金属
D. 热的碳酸钠溶液可去除油污,碳酸氢钠常用于中和胃酸
查看答案和解析>>
科目: 来源: 题型:
【题目】如图每一方框表示有关反应的某一反应物或生成物,有关操作已略去。又知A为高熔点物质,B为无色气体,D为一种天然出产的矿石的主要成分,可作为颜料。试回答:
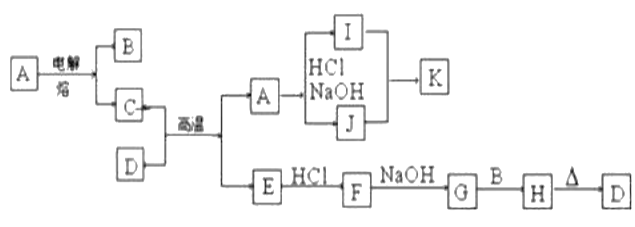
(1)写出下列物质的化学式:I____________,F____________。
(2)G转化为H的现象是____________,对应化学方程式为____________。
(3)写出I和J反应生成K的离子方程式____________。
(4)写出C+D→A+E的化学方程式________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe2O3具有广泛的用途。甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
实验步骤 | 实验操作 |
Ⅰ | 取一定质暈的FeCO3固体置于 中,高温煅烧至质量不再减轻,冷却至室溫 |
Ⅱ | 取少量实验步骤Ⅰ所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
由此甲同学得出结论:4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
(1)Ⅰ中横线处所需的化学仪器为______________________________________。
(2)写出实验步骤Ⅲ中发生反应的离子方程式_____________________________。
(3)乙同学提出不同看法:煅烧产物可能是Fe304,因为Fe304也可以溶于硫酸,且所得溶液中也含有Fe3+。于是乙同学对甲同学的实验步骤Ⅲ进行了补充改进:检验实验步骤Ⅱ所得溶液中是否含有Fe2+。他需要选择的试剂是___________________(填序号)。
a.氯水
b.氯水和KSCN溶液
c.酸性高锰酸钾溶液
(4)丙同学认为即使得到了乙同学预期的实验现象,也不能确定煅烧产物的成分。你认为丙同学持此看法的理由是______________________________________。
(5)丙同学进一步査阅资料得知,煅烧FeCO3的产物中的确含有+2价铁元素。于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:稀硫酸、_____________(填名称)和____________(填名称);再___________________(填操作名称),灼烧,即可得到Fe203。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
温度/oC | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)该反应的化学平衡常数表达式为K=______________________。
(2)上述正向反应是_________________(填“放热”或“吸热”)反应。
(3)某温度下,上述反应达到平衡时,恒容、升高温度,原化学平衡向_________(填“正”或“逆”)反应方向移动,正反应速率___________(填“增大”“减小”或“不变”),容器内混合气体的压强_____________(填“增大”“减小”或“不变”)。
(4)有830oC时发生上述反应,按下表中的物质的量投入恒容反应器,其中在向正反应方向进行的有____________(选填A、B、C、D)。
A | B | C | D | |
n(CO2)/mol | 3 | 1 | 0 | 1 |
n(H2)/mol | 2 | 1 | 0 | 1 |
n(CO)/mol | 1 | 2 | 3 | 0.5 |
n(H2O)/mol | 5 | 2 | 3 | 2 |
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关,下列有关物质的用途叙述错误的是( )
A.Ca(ClO)2用于消毒杀菌B.用铝制容器盛装稀硫酸
C.Fe2O3用于炼铁D.氧化镁作耐火材料
查看答案和解析>>
科目: 来源: 题型:
【题目】做焰色反应实验用的铂丝,每试验一种样品后都必须进行的操作是( )
A. 用水洗涤2~3次后再使用
B. 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用
C. 用滤纸擦干后才可使用
D. 用盐酸洗涤后,经蒸馏水冲洗,方可使用
查看答案和解析>>
科目: 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1molL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图 所示。下列判断正确的是
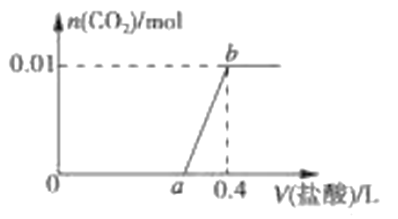
A. 在0a范围内,只发生NaOH和HCl的反应
B. ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.2molMn02和50mL12mol/L盐酸混合后加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发)( )
A. 等于0.3mol B. 小于0.3mol C. 大于 0.3mol,小于 0.6mol D. 等于 0.6mol
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)根据氧化还原反应2H2+O2===2H2O,设计成燃料电池,负极通的气体应是___________。
(2)如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是_____。

A.a电极是负极
B.b电极的电极反应为4OH--4e-====2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(3)根据氢氧燃料电池电解质溶液的不同,填写下表:
电解质溶液 | H2SO4溶液 | KOH溶液 |
负极反应 | ______________ | |
正极反应 | ___________ | |
溶液的pH变化 | _____________ |
(4)若把H2改为CH4,KOH溶液作电解质溶液,则负极反应为_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com