
科目: 来源: 题型:
【题目】工业上烟气脱氮的原理 NO(g) + NO2(g) + 2NH3(g)2N2(g) + 3H2O(g)+Q(Q>0)
(1)该反应化学平衡常数 K 的表达式为_____________________。如果平衡常数 K 值增大,对_______(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是______(填序号)
a.容器内混合物的质量不变
b.容器内气体的压强不变
c.反应消耗 0.5mol NO 的同时生成 1mol N2 d.NO2 的浓度不变
(3)向 2 L 密闭容器中加入反应物,10 min 后达到平衡,测得平衡时气体的物质的量增加了 0.2mol,则用H2O(g)表示的平均反应速率为__________________。
(4)如图是 P1 压强下 NO 的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为P2(P2> P1)下 NO 的转化率随反应时间变化的示意图________________。

(5)写出反应物中的氨气的电子式______;其空间构型为______;它常用来生产化肥 NH4Cl。NH4Cl 溶液显_____________性;常温下将等体积等浓度的氨水和NH4Cl溶液混合,pH>7,溶液中 NH3·H2O、H+、OH-、NH4+、Cl 一浓度由大到小的关系是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子反应方程式正确的是
A. 氯气溶于水:![]()
B. 碳酸氢钠和氢氧化钠溶液反应:HCO3-+OH-=CO32-+H2O
C. ![]() 溶液中加入
溶液中加入![]() 溶液:
溶液:![]()
D. 铁和稀硝酸反应:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)NA表示阿伏加德罗常数的数值.46g NO2和N2O4的混合气体中含有_____NA个氧原子;2L0.6 mol·L1 Fe(NO3)3溶液中含_____NA个NO3—离子.
(2)三氟化氮(NF3)是一种气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。
①写出该反应的化学方程式_________________________________
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2NF3+3NH4F;据题意推测NF3,F2,NO三种气体中,氧化性由强到弱的顺序为________________________
(3)H2C2O4溶液和KMnO4酸性溶液可发生反应:___H2C2O4+___MnO4﹣+___H+→___CO2↑+___Mn2++___H2O,反应中每生成标况下4.48L CO2气体,外电路中通过的电子的物质的量为___________mol.
(4)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2∶1,写出该反应的化学方程式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了验证氯气的氧化性,将氯气分别通入①KI溶液、②H2S溶液、③FeBr2溶液中:
(1)如果要将①中反应后的单质氧化产物从水溶液中分离,需先进行_________(填操作名称),然后进行分液即可;
(2)溶液②中出现淡黄色的沉淀,且反应后溶液呈强酸性,试写出反应的化学方程式__________________________________________________________________;
(3)反应③进行一段时间后振荡,溶液呈黄色,罗同学提出溶液变色的原因可能生成Br2 或Fe3+,请问他该如何通过实验确认生成Br2(限选用的试剂有:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硝酸银溶液、淀粉—碘化钾溶液)__________________;如果生成的是Fe3+,请写出反应的离子方程式:________________________________;
(4)已知:
Ⅰ.氧化性Cl2>HIO3>Br2>Fe3+>I2
Ⅱ.2Fe3++2I-=2Fe2++I2
将FeBr2、FeI2和HBr(强酸)溶于水,往溶液中通入过量Cl2,各反应或生成的微粒随氯气通入量的变化如下图所示
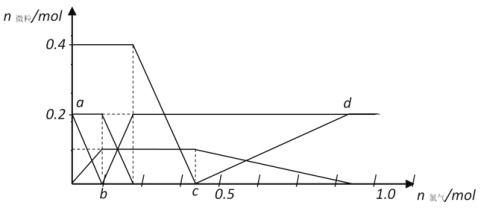
请回答:
①通过实验如何证明ab段反应已开始进行_____________________________;
②c点之前溶液中的阴离子总物质的量最大时为____________mol;
③cd段发生反应的化学方程式为_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 25℃时有关弱酸的电离平衡常数:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列有关说法正确的是
A. 1 mol·L-1HCN溶液与1mol·L-1 NaOH溶液等体积混合后,测得所得溶液显酸性
B. 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
C. NaHCO3溶液中,一定有c(Na+)=c(HCO3-)+c(CO32-)
D. 1mol/L醋酸溶液加水稀释,所有离子浓度均减小
查看答案和解析>>
科目: 来源: 题型:
【题目】能够鉴定氯乙烷中氯元素的存在的操作是
A. 在氯乙烷中直接加入AgNO3溶液
B. 在氯乙烷中加蒸馏水,然后加入AgNO3溶液
C. 在氯乙烷中加入乙醇,加热,然后加入AgNO3溶液
D. 在氯乙烷中加入NaOH溶液,加热后酸化,然后加入AgNO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】现用98%浓硫酸(密度1.84 g·cm3)配制浓度为0.5 mol·L1稀硫酸500mL.
(1)选用的主要仪器有:_________、________、__________、_______、
__________;
(2)请将下列操作按照正确的序号填在横线上___
A.用量筒量取浓硫酸
B.反复颠倒摇匀
C.用胶体滴管加水至刻度
D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶
E.稀释浓硫酸
F.将溶液转入容量瓶
(3)所需浓硫酸的体积为______mL.
(4)将浓硫酸沿着烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是______;若搅拌过程中有液体溅出,会使最终结果______(填偏高、偏低或无影响)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知图一表示的是可逆反应CO(g)+H2(g) ![]() C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g) ![]() N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是

A.图一t2时改变的条件可能是升高了温度或使用了催化剂
B.若图一t2时改变的条件是增大压强,则反应的ΔH增大
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com