
科目: 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
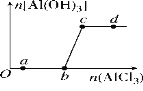
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:Ag+、Ca2+、NO3-、F-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.胶体粒子不能透过滤纸
B.按照分散质和分散剂的状态,分散系可分为9种
C.向豆浆中加入盐卤或石膏做豆腐 与胶体性质无关
D.溶液是电中性的,胶体是带电的
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某同学为探究酸性KMnO4溶液和H2C2O4(草酸,二元弱酸)溶液的反应过程,进行如下实验。请完成以下问题:
①写出酸性KMnO4溶液和H2C2O4的离子方程式___________________________________。
②配制100mL0.0400mol·L-1的H2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是_______________________________________。
③将KMnO4溶液逐滴滴入一定体积的酸性H2C2O4溶液中(温度相同,并振荡),记录的现象如下:
滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
先滴入第1滴 | 60s |
褪色后,再滴入第2滴 | 15s |
褪色后,再滴入第3滴 | 3s |
褪色后,再滴入第4滴 | 1s |
请分析KMnO4溶液褪色时间变化的可能原因___________________________________。
(2)![]() 和
和![]() 在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中![]() 随c(H+)的变化如图所示
随c(H+)的变化如图所示

①用离子方程式表示溶液中![]() 和
和![]() 的转化反应_________。
的转化反应_________。
②由图可知,溶液酸性减小, ![]() 的平衡转化率_________(填“增大”“减小”或“不变”)。
的平衡转化率_________(填“增大”“减小”或“不变”)。
③升高温度,溶液中![]() 的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,下列说法不正确的是( )


A.反应过程(1)的热化学方程式为A2(g)+B2(g)C(g)ΔH1=-Q1 kJ/mol
B.反应过程(2)的热化学方程式为C(g)A2(g)+B2(g)ΔH2=+Q2 kJ/mol
C.Q1与Q2的关系:Q1>Q2
D.ΔH2>ΔH1
查看答案和解析>>
科目: 来源: 题型:
【题目】关于物质的类别,下列说法正确的是
A.食盐水、糖水和冰水都是饮料,属于混合物
B.O2不能导电,故O2是非电解质
C.SO2属于氧化物、 HCl属于强酸
D.NaHSO4能电离出氢离子,故NaHSO4属于酸
查看答案和解析>>
科目: 来源: 题型:
【题目】糖类、油脂和蛋白质是生命活动所必需的营养物质。下列叙述正确的是
A.植物油不能发生水解反应B.葡萄糖能发生氧化反应和水解反应
C.淀粉水解的最终产物是葡萄糖D.蛋白质遇浓硫酸变为黄色
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. 需要加热才能发生的反应一定是吸热反应
B. CO(g)的燃烧热ΔH=-283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ/mol
D. 已知在120 ℃、101 kPa下,1 g H2燃烧生成水放出121 kJ热量,其热化学方程式为H2(g)+![]() O2(g)===H2O(l) ΔH=-242 kJ·mol-1
O2(g)===H2O(l) ΔH=-242 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。Na2CO3俗称纯碱,已知25℃时,CO32-第一步水解的平衡常数Kh=2×10-4mol/L,当溶液中c(HCO3-):c(CO32-)=20∶ 1 时,溶液的pH=______。
(2)为了除去银器表面Ag2S,可采用如下方法:在一个铝制的容器中放入食盐溶液,将银器浸入食盐溶液,使银器与铝接触良好形成原电池.过一段时间,银器表面变为银白色,并闻到臭鸡蛋的气味,观察到有少量白色絮状沉淀生成,则原电池的正极反应为______________________________,请解释臭鸡蛋气味形成的原因(用离子方程式表示)________________________________________。

(3)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=11时,溶液中的c(H2S)+c(HS-)=________mol·L-1。
②某溶液含0.040 mol·L-1M2+、0.10 mol·L-1H2S,当溶液pH=________时,Mn2+开始沉淀。[已知:Ksp(MS)=5.6×10-17]
(4)Na2S2O3溶液常作为标准液测定物质的组成。
I.取3.92 g某铁的氧化物,溶于足量稀硫酸,并配制成100.0 mL溶液;
II.取10.00 mL所得溶液,加入足量KI溶液,滴加几滴指示剂;
III.用0.2000 mol L-1的Na2S2O3标准溶液滴定,重复2~3次,平均消耗标准液20.00mL。
已知:I2+2S2O32-= S4O62-+2I-。则:
①步骤II 所用指示剂的名称为____________;判断达到滴定终点的操作和现象___________________。
②该铁的氧化物的化学式为______________。
(5)常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如上图,其中三条线代表的是A2-、H2A和HA-浓度变化的曲线,根据图示,当V(NaOH)=20 mL时,溶液中Na+、HA-、 A2-、 H2A四种微粒浓度大小关系:__________________________________。溶液显_______性。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关判断的依据不正确的是( )
A.氧化还原反应:是否有元素化合价的变化
B.共价化合物:是否含有共价键
C.放热反应:反应物的总能量大于生成物的总能量
D.化学平衡状态:平衡体系中各组分的的质量分数不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com