
科目: 来源: 题型:
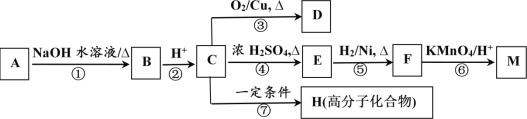
【题目】有机物AM有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应,F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与NaOH溶液反应后的产物,其一氯代物只有一种。
![]()
请回答:
(1)C、F的结构简式分别为___________________________、_______________________________。
(2)反应①⑦中,属于消去反应的是___________________(填反应序号)。
(3)反应③化学方程式为_____________________________________________________________;
反应⑦的化学方程式为_________________________________________________________。
(4)符合下列条件F的所有同分异构体的结构简式为_______________________________。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
查看答案和解析>>
科目: 来源: 题型:
【题目】K2Cr2O7是一种重要的化工原料。以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、Fe2O等杂质)为原料制备K2Cr2O7的一种工艺流程如下:

已知:(a) Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(b)不同温度下各物质的溶解度
物 质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度(g/100g H2O) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 70 | 376 | |
(c)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4+Fe2O3+CO2+NaNO2(未配平)。
Na2CrO4+Fe2O3+CO2+NaNO2(未配平)。
(1) “滤渣1”和 “滤渣2”的主要成分分别是_________,_________(填化学式).
写出③的离子反应方程式________________________________________;
步骤④中调PH可选用以下试剂__________。
A、NH3 B、 KOH C、CH3COOH D、 HCl
(2)在步骤⑤中加入适量KCl,____________________,过滤得到K2Cr2O7固体。
(3)某工厂用akg 铬铁矿粉(含Cr2O3 40%)制K2Cr2O7,最终得到产品 b kg,产率为_____________________________×100%。(列计算式)。
(4)化还原法可除去废水中的Cr2O72-,取含Cr2O72-的模拟水样分别在不同PH条件下,向每个水样中分 别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定铬去除率,实验结果下图所示。

①在酸性条件下,NaHSO3使Cr2O72-还原成为Cr3+,请写出NaHSO3与Cr2O72-反应的离子方程式:____________________________________。
② pH>8时,亚铁盐对+6价Cr的去除效果反而下降,可能的原因是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】软锰矿的主要成分为MnO2,还含有MgO、CaO、FeO、Fe2O3、Al2O3等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:

已知:① 几种常见金属离子形成氢氧化物沉淀时的pH值如下表:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Mg(OH)2 |
开始沉淀pH | 7.0 | 2.7 | 3.7 | 8.1 | 9.6 |
完全沉淀pH | 9.2 | 3.2 | 5.2 | 10.2 | 11 |
② 温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低。
(1)已知:25℃、101kpa时,
Mn(s)+O2(g)=MnO2(s) △ H=-520 kJ/mol
S(s)+O2(g)=SO2(g) △ H=-297 kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(aq) △ H=-1065 kJ/mol
“浸出”过程中MnO2转化为MnSO4的热化学方程式为___________________________。
(2) “第1步除杂”是为了除去浸出液中的Fe3+、Fe2+、Al3+,加入H2O2溶液的目的是(用离子方程式表示)____________________________________________,需要调节的pH的范围是_________________;所加的试剂X是_________ (填以下物质序号)。
A、MnO2 B、MnCO3 C、KMnO4 D、NaOH。
请用平衡移动原理分析,加入X能使除去浸出液中Fe3+的原因是:_______________。
(3)根据下表数据,选择“第2步除杂”所加的物质Y(由一种阳离子和一种阴离子组成),物质Y的化学式____________。
阴离子 Ksp 阳离子 | CO32- | F- | OH- |
Ca2+ | 5.0×10-9 | 1.5×10-10 | 4.7×10-6 |
Mg2+ | 3.8×10-6 | 7.4×10-11 | 5.6×10-12 |
Mn2+ | 2.2×10-11 | 5.3×10-3 | 2.1×10-13 |
(4)采用“系列操作”中需要“趁热过滤”,其目的是_______________________________。
(5)以MnSO4溶液为原料,采用电解的方法可制备高纯度的MnO2,则电解池阳极的电极反应方程式为___________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. C3H2Cl6有5 种同分异构体
B. β-月桂烯的结构如图![]() 所示,该物质与等物质的量溴发生加成反应的产物(不考虑立体异构) 理论上最多有4种
所示,该物质与等物质的量溴发生加成反应的产物(不考虑立体异构) 理论上最多有4种
C. 相同物质的量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的量相同
D. CH3-CH=CH-C≡C-CF3分子结构中6个碳原子可能都在一条直线上
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于Na和Na+的叙述中,错误的是
A. 它们相差一个电子层
B. 它们的化学性质相似
C. 钠原子,钠离子均为同一元素
D. 灼烧时,它们的焰色反应都呈黄色
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方法中,不能用于实验室制取氨的是
A. 加热试管中的氯化铵固体
B. 在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
C. 将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
D. 将烧瓶中的浓氨水加热
查看答案和解析>>
科目: 来源: 题型:
【题目】如图纵坐标代表沉淀的质量,横坐标代表加入溶液的体积,符合下列图像的是:
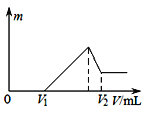
A.向硫酸溶液中加入氢氧化钡溶液
B.向碳酸氢钠溶液中加入氯化钙
C.向硫酸、硫酸镁、硫酸铝的混合溶液中逐滴加入氢氧化钠溶液直至过量
D.向氯化铝溶液中加入过量氢氧化钠溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中书写正确的是
A. 向FeCl2溶液中通入Cl2:Fe2+ + Cl2 = Fe3+ + 2Cl-
B. Ba(OH)2溶液与硫酸的反应:OH- + H+ = H2O
C. 碳酸氢钠溶液与NaOH溶液反应:HCO3-+OH- = CO32-+H2O
D. 将铁粉与水蒸气共热:2Fe+3H2O(g)![]() Fe2O3+3H2
Fe2O3+3H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com