
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A. 60g丙醇中存在的共价键总数为10NA
B. 1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C. 钠在空气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子数为1NA
D. 235g核互U![]() 发生裂变反应:
发生裂变反应:![]() +
+![]() n
n![]()
![]() +
+![]() +10
+10![]() n,净产生的中子(
n,净产生的中子(![]() n)数为10NA
n)数为10NA
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是( )
A. 1 L 0.1 mol·L-1 NaF溶液中含有0.1NA个F-
B. 32 g硫跟足量金属铜反应转移电子数为2NA
C. 48 g O2和O3的混合气体中含有3NA个氧原子
D. 1 mol H2O中含有2NA个共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2-丁烯有顺、反两种异构体,在其条件下可种气体处于平衡,

 (g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
下列说法正确的是
A. 顺-2-丁烯比反-2-丁烯稳定
B. 加压和降温有利于平衡向生成顺-2- 丁烯反应方向移动
C. .顺-2-丁烯的燃烧热比反-2-丁烯小
D. 反-2-丁烯氢化的热化学方程式为 (g)+H2(g)→CH3CH2CH2CH3(g) △H=-114.7kJ/mol
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-114.7kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】把1.0mol/L CuSO4溶液、1.0mol/L Fe2(SO4)3溶液两种溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度为
A. 1.0 mol/L B. 2.0 mol/L C. 3.0 mol/L D. 4.0 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】己知:![]() (主要产物),1mol某烃A充分燃烧后可以得到9molCO2和5molH2O,烃A中含有苯环,且苯环上有两种类型氢。该烃A在不同条件下能发生如下所示的一系列变化。填空:
(主要产物),1mol某烃A充分燃烧后可以得到9molCO2和5molH2O,烃A中含有苯环,且苯环上有两种类型氢。该烃A在不同条件下能发生如下所示的一系列变化。填空:
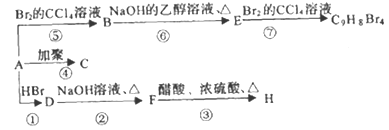
(1)A的分子式为___________________。
(2)上述反应中,③是________________反应,⑥是_________________反应。(填反应类型)
(3)写出下列物质的结构简式:C________________,E_______________,H_______________。
(4)写出D→F反应的化学方程式__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】环己酮实验室合成的反应如下:
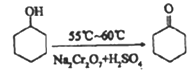
环己醇和环己酮的部分物理性质见下表:
物质 | 相对分子质量 | 沸点(℃) | 密度(g·cm-3、20℃) | 溶解性 |
环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯。其主要步骤有(未排序):
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.往液体中加入NaCl固体至饱和,静置,分液
d.过滤
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分提纯步骤的正确顺序是____________________。
(2)b中水层用乙醚萃取的目的是______________________。
(3)以下关于萃取分液操作的叙述中,不正确的是______________
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
D.经几次振荡并放气后,手持分漏斗静置液体分层
(4)在上述操作c中,加入NaCl固体的作用是____________________。蒸馏除乙醚的过程中采用的加热方式为_____________________。
(5)蒸馏操作时,一段时间后发现未加沸石,应采取的正确方法是______________________。
(6)利用红外光谱可以分析出环己酮的官能团为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物是日常生活生产中应用广泛的材料。请回答下列问题:
(1)基态铁原子的价电子轨道表达式为_____________________ 。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+____Fe3+(填“大于”“”或“小于”),原因是______________________ 。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为_________________(标出配位键),空间构型为_______________,其中氮原子的杂化方式为_______________;与ClO4-互为等电子体的分子或离子有______(任写一种)。
(4)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该氧化物中Fe2+、Fe3+、O3-的个数比为___________(填最简整数比)。
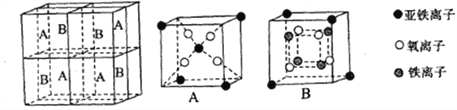
(5)铁有δ、γ、α三种同素异形体,如下图所示。

γ-Fe晶体的一个晶胞中所含有的铁原子数为________,δ-Fe、α-Fe两种晶胞中铁原子的配位数之比为_________。
已知δ-Fe晶体的密度为dg/cm3,NA表示阿伏伽德罗常数的数值,则Fe原子半径为_______Pm(列表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol NaOH的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. (2b-a) mol·L-1 D. (10b-5a) mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com