
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图甲表示某吸热反应在无催化剂(a)和有催化剂(b)时反应的能量变化
B. 图乙表示常温下,0.1mol/LNaOH溶液滴定20.00mL0.1mol/L醋酸溶液的滴定曲线
C. 图丙表示某可逆反应的反应速率随时间的变化关系,t0时刻改变的条件是使用了催化剂
D. 图丁表示一定质量冰醋酸加水稀释过程中、溶液导电能力变化曲线,且醋酸电离程度:a<b<c
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)(题文)在恒温、恒容条件下,能说明可逆反应:H2(g)+I2(g) 2HI(g)达到平衡状态的是
A. 气体的压强保持不变 B. v(H2)正=2v(HI)逆
C. 气体的密度保持不变 D. 气体的颜色保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】1.76 g铜镁合金完全溶解于50 mL、密度为1. 40 g cm-3、质量分数为63%的浓硝酸中,得到NO2气体1 792 mL(标准状况),向反应后的溶液中加入适量的1.0 mol L-1的NaOH 溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
A. 该浓硝酸中的HNO3的物质的量浓度是14.0 mol L-1
B. 加入NaOH溶液的体积是50 mL
C. 浓硝酸在与合金的反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08 mol
D. 得到的金属氢氧化物的沉淀为3.12 g
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、IV四步中对于溶液和沉淀的分离采取的方法是_________;获得沉淀后,要对沉淀进行洗涤,请简述洗涤沉淀的操作是______________________________________。
(2)根据上述框图反应关系,写出下列B、E所含物质的化学式并回答相关问题:
固体B_______;溶液液E_______;沉淀D的重要用途是__________________;KAl(SO4)2的重要用途是_____________________________。
(3)写出写出①、②、③三个反应的离子方程式:①______;②______;③______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
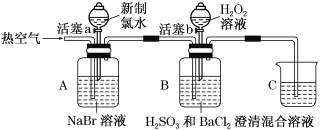
实验记录如下:
实验操作 | 实验现象 | |
Ⅰ | 打开活塞a,滴加少量新制氯水,关闭活塞a | A中溶液变为浅红棕色 |
Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | B中开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)实验操作Ⅰ时,A中反应的离子方程式为__________________________。
(2)实验操作Ⅱ吹入热空气的目的是________________________________。
(3)装置C的作用是______________________;C中盛放的药品是________。
(4)实验操作Ⅲ中混合液逐渐变成红棕色,其对应的离子方程式为_____________。
(5)由上述实验得出的结论是______________________________________。
(6)①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否有干扰,理由是_______________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是________________(写出一条即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯丁橡胶M是理想的电线电缆材料。工业上可由有机化工原料A 或E制得,其合成路线如下图所示。
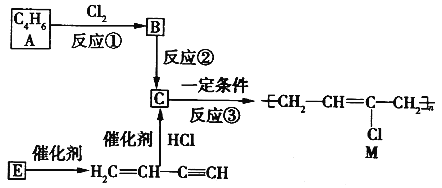
已知:①R-CH2-CH2Cl---R-CH=CH2+NaCl+H2O
②H2C=CH-C≡CH由E二聚得到。
完成下列填空:
(1)A的名称是________,反应③的反应类型是________。
(2)写出反应②的化学反应方程式_______________。
(3)为研究物质的芳香性。将E三聚、四聚成环状化合物: 写出它们的结构简式:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)系统命名法命名下列物质
①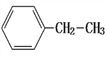 ________;②
________;②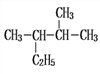 ________;③
________;③![]() ________;
________;
(2)C6H5CH2OH的类别是________,所含官能团的电子式为_________。
(3)已知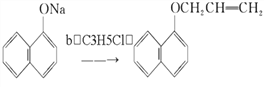 ,试剂b的结构简式为______,b中官能团的名称是________。
,试剂b的结构简式为______,b中官能团的名称是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL。请回答下列问题:
(1)配制稀盐酸时,应选用容量为____mL的容量瓶;
(2)经计算需要量取______mL浓盐酸,在量取时宜选用下列量筒中的______。(填字母)
A.10mL B.25mL C.50mL D.100mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入所选用的容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线1~2cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。
④用蒸餾水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
⑤配制完后,应将容量瓶中的稀盐酸转移到干燥洁净的试剂瓶中存放,盖好塞子并贴上标签。
上述操作中,正确的顺序是(填序号)__________________。
(4)在上述配制过程中,用刚刚用蒸馏水洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是______(填“偏高”、“偏低”、“无影响”)。若定容时,俯视刻度线,则配制的稀盐酸浓度是_______(填“偏高”、“偏低”、“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硅酸盐材料是传统的无机非金属材料。下面有关硅酸盐材料的说法正确的是( )
A.普通玻璃的主要成分是纯碱、石灰石和石英
B.制造水泥的主要原料是石灰石和黏土
C.水玻璃的成分是硅酸钠、硅酸钙和二氧化硅
D.陶器比瓷器的结构致密,几乎不吸水
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃与氢气发生反应后能生成(CH3)2CHCH2CH3,则该烃不可能是
A. 2-甲基-2-丁烯 B. 3-甲基-1-丁烯
C. 2.3-二甲基-1-丁烯 D. 3-甲基-1-丁炔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com