
科目: 来源: 题型:
【题目】按要求进行计算,直接写出结果
(1)标准状况下,2.24 L CH4所含氢原子的物质的量为____mol。
(2)含0.2 mol氧原子的NO2的质量是____g。
(3)100 mL 0.5mol· L-1 H2SO4溶液中,H+的物质的量浓度为____mol· L-1。
(4)1mol碳在一定量氧气中反应,生成气体的质量为36 g。所得气体的物质的量为____mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)化合物N具有镇痛、消炎等药理作用,其合成路线如下:

(1)A的系统命名为____________,E中官能团的名称为____________。
(2)A→B的反应类型为____________,从反应所得液态有机混合物中提纯B的常用方法为____________。
(3)C→D的化学方程式为________________________。
(4)C的同分异构体W(不考虑手性异构)可发生银镜反应:且1 mol W最多与2 mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有____________种,若W的核磁共振氢谱具有四组峰,则其结构简式为____________。
(5)F与G的关系为(填序号)____________。
a.碳链异构 b.官能团异构 c.顺反异构 d.位置异构
(6)M的结构简式为____________。
(7)参照上述合成路线,以![]() 为原料,采用如下方法制备医药中间体
为原料,采用如下方法制备医药中间体![]() 。
。

该路线中试剂与条件1为____________,X的结构简式为____________;
试剂与条件2为____________,Y的结构简式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合硫酸铁[Fex(OH)y(SO4)z](铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:①称取一定质量的聚合硫酸铁配成100.00 mL的溶液。②准确量取25.00 mL溶液,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体6.99g。③准确量取25.00mL溶液,加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥、灼烧至恒重,得到红棕色固体1.92g。该聚合硫酸铁组成中x∶y∶z的值为
A. 6∶8∶5 B. 4∶2∶5 C. 1∶1∶2 D. 6∶3∶5
查看答案和解析>>
科目: 来源: 题型:
【题目】将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:

A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
查看答案和解析>>
科目: 来源: 题型:
【题目】三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
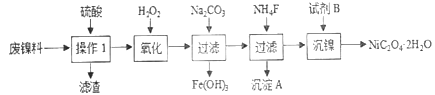
(1)操作1的名称为__________。
(2)保持其他条件相同,在不同温度下对废镍料进行“酸浸”,镍浸出率随时间变化如图。“酸浸”的适宜温度与时间分别为_______(填字母)。
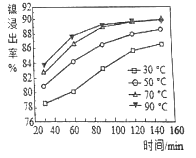
a.30℃、30min b.70℃、120min
c.90℃、150min d.90℃、120min
(3)沉淀A为CaF2和_________(填化学式)。
(4)试剂B的化学式为_________________。
(5)NiC2O4·2H2O样品经某稀酸酸化处理后,用稀KMnO4标准溶液滴定[在本实验条件下,Ni(Ⅱ)不能被氧化,其他物质不参与反应],通过测定草酸的量可测定NiC2O4·2H2O样品的纯度,滴定反应为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O。实验中称取0.183g样品,滴定时消耗了0.0400mol.L-1的KMnO4溶液8.00mL,则该样品中NiC2O4·2H2O的质量分数为_________。
(6)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。某同学设计如下实验流程进行检验。
混合气体![]() 现象
现象![]() 现象
现象![]()
![]() 现象
现象![]() 现象
现象
①试剂1的名称为____________。
②证明混合气体有CO的现象是_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为使以面粉为原料的面包松软可口,通常用NaHCO3作发泡剂,因为它( )
①热稳定性差 ②增加甜味 ③产生二氧化碳 ④提供钠离子
A. ②③ B. ①③ C. ①④ D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】将金属钠投入饱和MgCl2溶液中,下列现象合理的是
A.开始时,钠浮在液面上、四处游动并熔成小球
B.反应结束后,在溶液底部有银白色金属产生
C.反应结束后,在溶液中无沉淀生成
D.反应结束后,在溶液底部析出黑色固体
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组研究二价铁的还原性,设计如下实验。
序号 | 实验方案 | 现象 |
Ⅰ |
| 现象a:生成白色沉淀,3 min后沉淀基本变为红褐色 |
Ⅱ |
| 现象b:生成白色沉淀,3 min后沉淀颜色几乎不变 |
(1)实验所用的FeSO4溶液由Fe2(SO4)3溶液和足量铁粉反应制得,离子方程式是____。
(2)实验I中沉淀变为红褐色的化学方程式是________。
(3)关于实验II中白色沉淀的组成,小组同学展开研究。
① 已知Fe(HCO3)2在水中不存在。对沉淀组成作出如下假设,请补充完整。
假设a:依据NaHCO3溶液显_______性,推测白色沉淀可能为Fe(OH)2;
假设b:白色沉淀可能为_______。
② 研究白色沉淀组成的实验如下:
i.取少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量H2O2,溶液立即变为红色。
由此说明,白色沉淀中一定含有_________离子。
③ 研究过程中发现白色沉淀在空气中久置,最终变为红褐色。则该沉淀比实验I中所得的Fe(OH)2______(填“难”或“易”)于被空气氧化。
(4)对比实验I,研究酸碱性对二价铁还原性的影响,设计实验III:
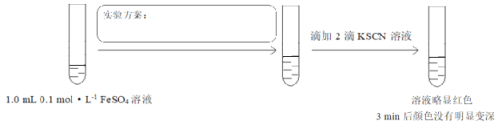
将实验方案补充完整______。
(5)据以上实验,为避免二价铁被空气氧化,可采取的措施是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com