
科目: 来源: 题型:
【题目】用下列实验装置进行相应实验,装置正确且能达到实验目的的是

A. 用图a所示装置验证H2在Cl2中燃烧的实验现象
B. 用图b所示装置从饱和食盐水中提取氯化钠
C. 用图c所示装置探究氧化性:KMnO4>Cl2>I2
D. 用图d所示装置分解MgCl2·6H2O获取MgCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】摩尔质量为Mg·mol-1的气态化合物VL (已换算成标准状况) 溶于mg 水中,得到溶液的溶质质量分数为ω%,物质的量浓度为cmol·L-1,密度为ρg·cm-3,则下列说法正确的是( )
A. M 可表示为![]() B. c 可表示为
B. c 可表示为![]()
C. ω%可表示为![]() D. ρ可表示为
D. ρ可表示为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验的叙述正确的是( )
A.用分液的方法分离水和酒精的混合物
B.进行分液时,分液漏斗中的上层液体上口倒出,下层液体下口流出
C.配制NaCl溶液时可用托盘天平称量5.85gNaCl固体
D.用滴管滴加液体时,为防止液滴溅出,滴管紧贴试管内壁
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中.溶液中的HCO3-浓度变化是先变大后变小(溶液体积变化均忽略不计)
B.向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化是先变大后变小(溶液体积变化均忽略不计)
C.有含0.2molNa2CO3和含0.3molHCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中,①②两种操作生成的CO2体积之比为3:2
D.将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是a=b
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作中都正确的选项是 ( )
①用剩的药品为避免浪费应放回原瓶
②蒸发氯化钠溶液时要用玻璃棒不断搅拌
③称取易潮解的药品必须放在玻璃器皿中称量
④浓硫酸的稀释时,将水沿烧杯内壁缓缓倒入,并不断搅拌
A.②③B.②③④C.②④D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】将标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是( )
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程,下列有关说法正确的是
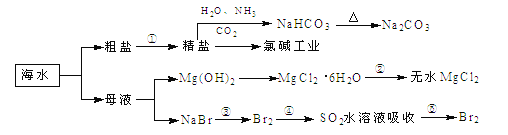
A. 制取NaHCO3的反应是利用其溶解度小于NaCl和NH4Cl
B. ①粗盐提纯中除去杂质离子Mg2+、Ca2+、SO42-时,必须先除Ca2+后除SO42-
C. 在工段③、④、⑤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 22.4L CO2与足量Na2O2完全反应,转移电子数为2NA
B. 6.4 g 由S2、S4、S8组成的混合物含硫原子数为0.2NA
C. 1mol/L的NaCl溶液中Cl—的数目为NA
D. 标况下,22.4L NO和11.2L O2,混合后气体分子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】为研究(NH4)2 SO4 和 NH4HSO4混合物样品组成,称取四份该样品分别逐滴加入相同 浓度的 NaOH 溶液 40.0 mL,加热并完全反应,产生 NH3的体积(已折算成标准状况,
不考虑NH3在水中的溶解)如下表:
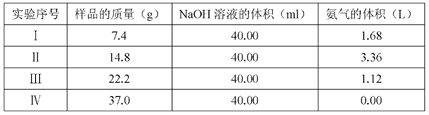
(1)样品中(NH4)2 SO4和NH4HSO4的物质的量之比为_____________。
(2)NaOH 溶液的物质的量浓度为_________________________(精确到0.1)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钒的化合物常用于制作催化剂和新型电池。回答下列问题:
(1)金属钒可由铝热反应制得。已知25℃、101 kPa时,
4A1(s)+3O2(g)=2Al2O3 (s) △H1=a kJ·mol-1
4V(s) +5O2 (g)=2V2O5(s) △H2=b kJ·mol-1
则用铝热反应冶炼金属V(s)的热化学方程式为_____________________。
⑵V2O5为橙黄至砖红色固体,无味、有毒,微溶于水,是许多有机和无机反应的催化剂。下图表示的是25℃时,部分含钒微粒的存在形式、浓度和存在的pH范围(其余可溶性微粒均未标出),图中“[V]”表示含钒微粒的浓度,虚线表示[V]或pH的范围尚未准确确定。
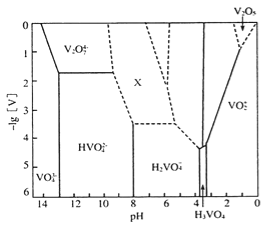
①V2O5溶于足量2mol L-1NaOH溶液中,发生反应的离子方程式为_________________,向反应后的溶液中,滴加硫酸溶液至过量(pH<1)的过程中,开始溶液保持澄淸,滴加一段时间后,观察到有橙黄色沉淀产生,继续滴加硫酸溶液,沉淀又消失。则沉淀消失过程中发生反应的化学方程式为_______________。
②上述滴加硫酸溶液的过程中,先后发生如下反应:

则“X所示区域溶液中的离子”不可能是___________(填序号);
a.V3O93- b.V4O103- c. V4O124-
(3)V2O5是反应2SO2+O2![]() 2SO3的催化剂。其他条件不变,加入V2O5后,该反应的速率加快的原因是_______________;恒温恒压下,加人V2O5,该反应的平衡常数________________ (填“增大”、 “减小”或“不变”);
2SO3的催化剂。其他条件不变,加入V2O5后,该反应的速率加快的原因是_______________;恒温恒压下,加人V2O5,该反应的平衡常数________________ (填“增大”、 “减小”或“不变”);
(4)下图所示为可充电的全钒液流电池构造示意图,该电池中的隔膜只允许H+通过。电池放电时,负极区溶液的pH将_____________(填“增大”、“减小”或“不变”),电池充电时,阳极的电极反应式为_____________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com