
科目: 来源: 题型:
【题目】关于电解槽的叙述不正确的是( )
A. 是电能转变成化学能的装置B. 与电源正极相连的是阳极
C. 阴极失去电子,发生氧化反应D. 参与电解的阳离子移向阴极
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关生物体内化合物的叙述,正确的是( )
A. 所有细胞中都含有蛋白质和磷脂
B. N是组成细胞内各种有机物的必需元素
C. 氨基酸脱水缩合产生水,水中的氢都来自氨基
D. 细胞核内的核酸只含脱氧核糖,细胞质中的核酸只含核糖
查看答案和解析>>
科目: 来源: 题型:
【题目】欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:
方法二:
方法三:
方法四:运用化学原理,但不使用其他化学试剂,仅使用实验室常用仪器达到实验目的。
按要求回答下列问题:
(1)方法一:加入足量的试剂A ______________ (填写A的化学式)可将HCO3―离子转化为沉定并称重,反应的离子方程式为 ______________。操作1、2、3、4的名称依次是溶解、______________ 、洗涤和干燥(烘干)。
(2)方法二:在操作1中配制100 mL待测液所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要用到的是 ______________,操作2中选择甲基橙作指示剂,计算该样品中NaHCO3的质量分数为 ______________ [用流程图中的数据m、V(HCl),填写有关的表达式]。
(3)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是______________。
(4)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是______________,偏低的原因可能是______________ (均用文字简述)。
(5)方法四的实验原理是:______________ (用化学方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料生产铝和氮化铝的一种工艺流程如下[已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀]。

(1)操作I、Ⅱ的名称为____________。
(2)用氧化物的形式表示铝硅酸钠的化学式_____________。
(3)杂质Fe2O3最后存在于___________中。
(4)工业制备Al的化学方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列除杂质的操作方法正确的是( )
A.NO中有少量的NO2:用水洗涤后再干燥
B.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
C.N2中有少量的CO:通过灼热的氧化铜
D.NO2中有少量NH3:用水洗涤后干燥
查看答案和解析>>
科目: 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO等)制取CoC12·6H2O粗品的工艺流程图如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、A13+等;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
请回答下列问题:
(1)上述工艺流程图中操作a的名称:_______________。
(2)写出“浸出”时Co2O3发生反应的离子方程式:____________________。
(3)加入NaC1O3的作用是________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图。使用萃取剂最适宜的pH范围是_________(填字母序号)。
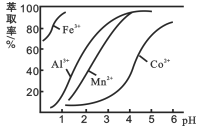
A.2.0~2.5 B. 3.0~3.5 C. 5.0~5.5 D. 9.5~9.8
(5)“除钙”“镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11, Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于组成生物体的化学元素的叙述,正确的是( )
A. 组成细胞的化学元素大多以化合物的形式存在
B. 细胞中常见的化学元素有60种
C. C元素是组成细胞的最基本元素,因为C元素含量最多
D. K、Ca、Zn属于大量元素
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是________(填序号)。
①铝和盐酸、NaOH溶液的反应中,铝作还原剂
②等质量的铝与足量的盐酸、NaOH溶液反应放出的H2物质的量相等
③等体积等物质的量浓度的盐酸、NaOH溶液与过量的Al反应,产生H2的物质的量相等
④铝与NaOH溶液反应中,每转移3 mol e-,就生成1.5 mol H2
⑤化学方程式中各物质的化学计量数之比等于各物质的质量之比
⑥根据方程式2Na+2H2O===2NaOH+H2↑,可知2 mol Na与足量水反应放出22.4 L氢气
⑦根据离子方程式Mg+2H+===Mg2++H2↑,可知1 g Mg与足量H+反应生成1 mol氢气
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置设计不能达到目的的是

A. 实验I:所示装置可制备氨气 B. 实验Ⅱ:检验电解饱和食盐水的产物Cl2
C. 实验Ⅲ:制取并观察Fe(OH)2沉淀 D. 实验IV:吸收SO2
查看答案和解析>>
科目: 来源: 题型:
【题目】结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界__________。
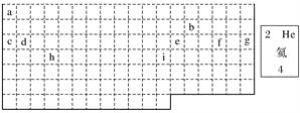
(2)表中所列元素,属于短周期元素的有________,属于主族元素的有________;g元素位于第________周期第________族;i元素位于第________周期第________族。
(3)元素f是第________周期第________族元素,请在下边方框中按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量。_____________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com