
科目: 来源: 题型:
【题目】25℃时,物质的量浓度均为0.1molL﹣1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)①中由水电离出的c(OH-)________(填“>”“=”或“<”)②中由水电离出的c(H+)。
(2)③中共存在______种粒子,pH=8.4的原因:_______________________________;
(3)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3﹣)+c(CO32﹣)=0.1molL﹣1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(4)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
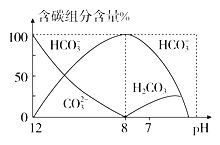
回答下列问题:
①当pH=7时,溶液中含碳元素的主要微粒为________
②已知在25 ℃时,CO![]() 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=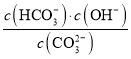 =2.0×10-4 mol·L-1,当溶液中c(HCO
=2.0×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=2∶1时,溶液的pH=______________。
)=2∶1时,溶液的pH=______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学小组学生利用下图所列装置进行 “铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
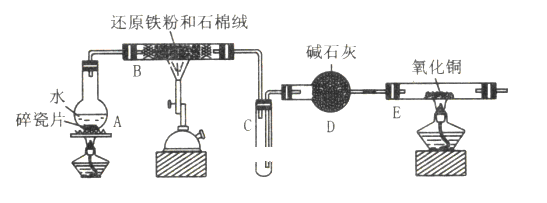
(1)装置B中发生反应的化学方程式是_________________________________________
(2)装置E中的现象是:_____________________________________________________
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中 Fe3+的操作方法:____________________________________________________________________
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
![]()
步骤I中通入Cl2的作用是____________________________
该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】随着工农业发展,NH4Cl的需求显著降低,价格低迷和产品积压导致利用“侯氏制碱法”生产的碱厂出现亏损。新联合制碱法在此基础上将氯元素转化为更有应用价值的HCl。

(1)气体X是__________。
(2)已知25℃时部分物质的溶解度数据:
物质 | NaCl | NaHCO3 | NH4Cl | NH4HCO3 |
溶解度/g | 36.0 | 10.3 | 39.5 | 24.8 |
结合表中数据说明过程Ⅰ中的反应能发生的原因是______________。
(3)过程Ⅰ获得的NaHCO3会吸附微量NH4Cl,导致产品Na2CO3中混有NaCl。
①用化学方程式表示过程Ⅱ中NaCl生成的原因:_____________。
②检验Na2CO3中NaCl的实验操作是,取少量固体于试管中_____________。
(4)过程Ⅲ以MgO为催化剂,在不同温度下加热灼烧,将NH4Cl分解为NH3和HCl。

①步骤i中反应的化学方程式是____________。
②过程Ⅲ的优点是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学上常用AG表示溶液中的lg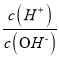 。25℃时,用0.100 molL-1的NaOH溶液滴定20.00 mL 0.100 molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
。25℃时,用0.100 molL-1的NaOH溶液滴定20.00 mL 0.100 molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
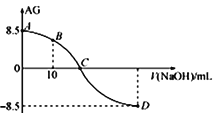
A. 滴定过程中,应选用甲基橙做指示剂
B. B点溶液中存在 c(H+)-c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积为20 mL
D. 25℃时,HNO2的电离常数Ka=1.0×10-4.5
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)我国是世界上最早使用湿法炼铜的国家。湿法炼铜的原理是Fe+CuSO4=FeSO4+Cu,其中铁被__________(填“氧化”或“还原”),CuSO4作________(填“氧化”或“还原”)剂。在该反应中,若生成了1 mol Cu,消耗Fe的物质的量是_________。
(2)某学习小组设计下图所示装置观察氧化还原反应中电子的转移。
实验Ⅰ | 实验Ⅱ | |
装置 |
|
|
现象 | 电流计指针向右偏转;铁片溶解; 铜片上有红色物质(铜)析出,铜片质量增加 | 电流计指针向右偏转;…… |
①实验Ⅰ中,Fe与CuSO4溶液反应的离子方程式是______________。
②根据实验Ⅰ的原理,推测实验Ⅱ中:锌片上发生_________(填“氧化”或“还原”)反应;铜片上的实验现象是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是

A.b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.图中b、c、d三点溶液中水的电离程度最大的是c点
C.b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D.pH=7时,溶液中c(H+)+c(Na+)+c(NH![]() )=c(SO
)=c(SO![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com