
科目: 来源: 题型:
【题目】(1)按要求书写下列化学方程式:①甲苯制备TNT
②1,3﹣丁二烯与等物质的量的单质溴在60℃时发生1,4加成
(2)现有下列6种与人们生产生活相关的有机物:①CH3COOH(调味剂) ②HCOOCH3(烟草熏蒸剂)
③![]() (制酚醛树脂)④
(制酚醛树脂)④![]() (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)
请回答:
(a)属于醛的是 (填序号).
(b)与①互为同分异构体的是 (填序号).
(c)与③互为同系物的是 (填序号).
(3)下列各组物质中,属于同一类物质的是( )
A. |
B. |
C. |
D. |
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物G(分子式为C13H18O2)是一种香料,下图是该香料的一种合成路线。
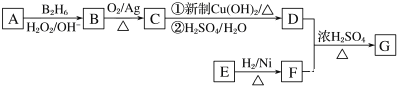
已知:
①E能够发生银镜反应,1molE能够与2molH2完全反应生成F;
②R—CH===CH2![]() R—CH2CH2OH;
R—CH2CH2OH;
③有机物D的摩尔质量为88g·mol-1,其核磁共振氢谱有3组峰;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链。
回答下列问题:
(1)用系统命名法命名有机物B:________________________________________。
(2)E的结构简式为________________________________。
(3)C与新制Cu(OH)2反应的化学方程式为___________________________。
(4)有机物C可与银氨溶液反应,配制银氨溶液的实验操作为___________________。
(5)已知有机物甲符合下列条件:①为芳香化合物;②与F互为同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有________种。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中没有硫生成的是 ( )
A. 空气中久置的氢硫酸 B. 氢硫酸中滴入少量稀溴水
C. SO2水溶液中通入H2S气体 D. 在足量氧气里充分燃烧H2S气体
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A的键线式为: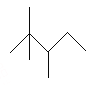 ,有机物B与等物质的量的H2发生加成反应可得到A。
,有机物B与等物质的量的H2发生加成反应可得到A。
下列有关说法错误的是
A. A的最简式为C4H9
B. A的一氯代物有5种
C. A有许多同分异构体,其中主链碳数为5有机物有5种(不包括A)
D. B的结构可能有3种,其中一种名称为:2,2,3—三甲基—3—戊烯
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四种有色溶液与SO2作用,均能褪色,①品红溶液 ②酸性KMnO4溶液 ③溴水 ④滴有酚酞的NaOH溶液,其实质相同的是 ( )
A. ①④ B. ①②③ C. ②③④ D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中的各字母表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A是金属单质;B是淡黄色固体; C、D、E为无色气体,D能使湿润的红色石蕊试纸变蓝;H是无色液体。

(1)写出下列各物质的化学式:
B:____________________________;F:_______________________ 。
(2)写出D→E反应的化学方程式为:______________________ 。
(3)写出G→E反应的离子方程式:________________________________ ;若该反应中转移电子总数为9.03 ×1023 ,则被还原的G为___________________ g 。
(4)写出实验室制取D的化学方程式________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】目前“低碳经济”正成为科学家研究的主要课题。请回答下列问题:
Ⅰ.甲烷自热重整是一种先进的制氢方法,其反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)阅读下图,计算上述反应的反应热ΔH=________kJ·mol-1。

Ⅱ.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为________________________________________________________________________。
(3)以CH4、O2为原料,100mL0.15mol·L-1NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为________________________,各离子浓度由大到小的顺序为________________________________________________________________________。
Ⅲ.利用I2O5消除CO污染的反应为5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4molCO,测得CO2的体积分数随时间t变化曲线如下图。请回答:
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4molCO,测得CO2的体积分数随时间t变化曲线如下图。请回答:
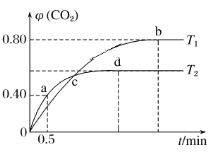
(4)T2时,0~0.5min内的反应速率v(CO)=________________。
(5)T1时化学平衡常数K=________。
(6)下列说法不正确的是________(填标号)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,增大体系压强,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com