
科目: 来源: 题型:
【题目】下列关于阿伏加德罗常数和气体摩尔体积等的说法正确的是 ( )
A. 标准状况下,1摩尔SO3的体积约为22.4L
B. 92克NO2气体在标准状况下的体积约为44.8L
C. 同温同压下两种气体的体积之比等于摩尔质量之比
D. 标准状况下,22.4L O2所含的分子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】A-F为中学化学常见物质,它们的焰色实验均为黄色。其中A为单质,B与C的组成元素相同,且B为淡黄色固体;D、E、F的溶液均显碱性,其中E和F属于盐,E被广泛用于玻璃、造纸和纺织等。它们之间的相互转化关系如下图。(“”表示一步反应即可转化,部分反应物、生成物和反应条件已略去)

请回答下列问题:
(1)写出下列物质的化学式:B___,C___,E___。
(2)AD的化学方程式是___。
(3)BD的化学方程式是___。
(4)区分E和F两种固体的方法是:分别取等量的E和F两种固体少许于试管中,操作,现象和结论是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下表空格中的烃分子式为_______,其有_______种同分异构体。
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
(2)化合物(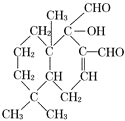 )是一种新型杀虫剂,其含氧官能团的名称为_____________________。
)是一种新型杀虫剂,其含氧官能团的名称为_____________________。
(3)CH2=CH-![]() -C≡C-CH3中,最多有_______个原子共面。
-C≡C-CH3中,最多有_______个原子共面。
(4)①根据名称书写结构简式:2-甲基-2,4-已二烯_________________________________
(5)有机物![]() 的系统命名是___________________________________,将其在催化剂存在下完全氢化,所得烷烃的系统命名是_________________________________
的系统命名是___________________________________,将其在催化剂存在下完全氢化,所得烷烃的系统命名是_________________________________
(6)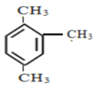 的系统命名是______________________________
的系统命名是______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】同学们在实验室里用不同的方法分别制取Cu(NO3)2,并在此基础上探究Cu(NO3)2的化学性质。
(1)甲组同学直接用铜屑与稀硝酸反应制取Cu(NO3)2,反应的化学方程式是___。
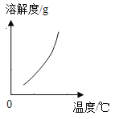
(2)乙组同学查阅了硝酸铜晶体的溶解度曲线(下图),据此设计了以下实验方案,先将铜粉在空气中充分灼烧,再将灼烧后的物质与适量稀HNO3反应,欲从反应后的溶液中得到Cu(NO3)2晶体,依次进行的操作是:蒸发浓缩、____________、过滤、洗涤、干燥。乙组同学认为此方案优于甲组的方案,理由之一是_____。
(3)丙组同学用Cu(NO3)2晶体,探究其热稳定性,实验装置如下所示。(夹持装置和加热仪器未画出)

①充分加热Cu(NO3)2晶体一段时间后,观察到U形管中气体变为红棕色,红棕色气体是____________。
②集气瓶中最终收集到的气体颜色是____________,U形管中进入集气瓶后颜色发生变化的原因是___。
③欲证明试管中残留的黑色粉末是CuO[假设Cu(NO3)2晶体已全部分解],实验方案是___。
④由该实验可得出的结论是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的化工原料,它的发现和研究经历了以下几个阶段。
(1)1774 年,舍勒在研究软锰矿(主要成分是二氧化锰)时,将软锰矿与浓盐酸混合并加热,无意间制得了氯气,此反应中氯元素被_______(填“氧化”或“还原”)
(2)贝托莱发现,氯气能溶于水,向此溶液中滴加紫色石蕊溶液,观察到的现象是_____________________。
(3)泰纳将氯气通入石灰水,并一步步改进,制得了我们现在常用的漂白粉,漂白粉的有效成分是__________________。
(4)盖吕萨克发现氯气能与金属反应。氯气与铝反应的化学方程式是_____________。
(5)1810 年,戴维经过大量实验研究,确认氯气是一种单质,且有毒。实验室吸收氯气的常用方法是___________________(用化学方程式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】2.8g Fe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,下列有关判断正确的是
A. 反应后溶液中c(NO3-)=0.85mol/L
B. 反应后的溶液最多还能溶解1.4gFe
C. 反应后溶液中铁元素可能以Fe2+形式存在
D. 1.12L气体可能是NO、NO2的混合气体
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=﹣92.4 kJ
2NH3(g)ΔH=﹣92.4 kJ![]() ,
,
2H2(g)+O2(g)====2H2O(l)ΔH=﹣571.6 kJ![]() ,
,
则2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=_______。
4NH3(g)+3O2(g) ΔH=_______。
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
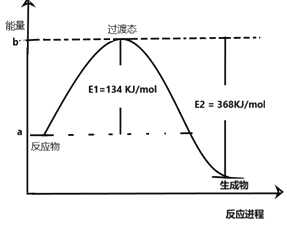
上图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出CO2和NO反应生成NO2和CO的热化学方程式:__________________________________。在反应体系中加入催化剂,E1和E2的变化是:E1__,E2__(填“增大”“减小”或“不变”),对反应热是否有影响?__(填“是”或“否”),原因是________________________________________。
(3)常温常压下断裂1 mol气体分子化学键所吸收的能量或形成1 mol气体分子化学键所放出的能量称为键能(单位为kJ·mol-1)。下表是一些键能数据(kJ·mol-1):请完成下列问题。
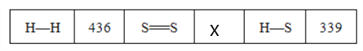
热化学方程式2H2(g)+S2(g)===2H2S(g) ΔH=-229 kJ·mol-1,则X=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com