
科目: 来源: 题型:
【题目】原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大。已知X是迄今为止形成化合物最多的元素。Y原子最外层电子数与核外电子总数之比为3∶4。M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物。Z、M、N 同周期,M2-、N-、Z+ 离子半径逐渐减小。W是第Ⅷ族元素中原子序数最小的元素。据此回答:
(1)写出W在周期表中位于哪一区:_____________,X与N按1:4形成的化合物中,X和N之间的σ键的类型:____________;
(2)用电子式表示Z与M形成化合物的过程_____________________________________;
(3)X、Y、M的电负性由小到大的顺序是____________________填元素符号);N3一与X、Y形成的一种化合物互为等电子体,则N3一的空间构型为________________;
(4)下图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:____________________
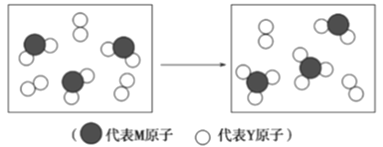
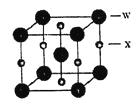
(5)X和W所形成的某种晶体结构如右图所示,写出: 基态W3+离子的结构示意图:_____________;
(6)N元素基态原子核外电子有_______种空间运动状态?
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。请填写下列空白:

(1)写出下列物质的化学式:
A________,B________,C________。
(2)写出下列反应的离子方程式、化学方程式:
A→C(离子方程式)___________________________________________________,
B→D(化学方程式)____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5流程:
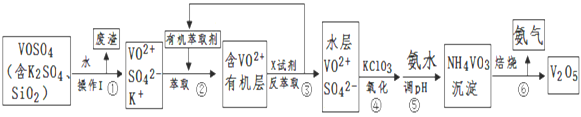
(1)步骤①所得废渣的成分是____________(写化学式),操作I的名称__________;
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层)![]() 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是_____________________________;
③中X试剂为(写化学式)______________________________________;
(3)④的离子方程式为 ___________________________________________;
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为____________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< _____________;(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有__________和_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】若用AG表示溶液的酸度(acidity grade),AG的定义为AG = lg[![]() ].室温下实验室中用0.01molL-1的氢氧化钠溶液滴定20.00mL 0.01molL-1的一元弱酸HA,滴定过程如图所示,下列叙述正确的是( )
].室温下实验室中用0.01molL-1的氢氧化钠溶液滴定20.00mL 0.01molL-1的一元弱酸HA,滴定过程如图所示,下列叙述正确的是( )

A. 室温下,弱酸HA的电离常数约为10-5
B. A点时加入氢氧化钠溶液的体积为20.00mL
C. 若B点为40mL,所得溶液中:c(OH-) = c(A-)+c(HA)+c(H+)
D. 反应过程中一定存在:0.01molL-1+c(OH-)=c(Na+)+c(HA)
查看答案和解析>>
科目: 来源: 题型:
【题目】 关于氯水说法正确的是
A、新制氯水中只含有Cl2、H2O分子
B、新制氯水可使蓝色石蕊试纸先变红后褪色
C、光照氯水有气泡冒出,该气体是主要是氯气
D、氯水久置后,溶液内与原来相比Cl-浓度保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z、Q、F是六种原子序数依次增大的前四周期元素,其中W的最外层电子数是其内层电子数的3倍,X是短周期中原子半径最大的元素,X、Y、Z为同周期元素,Y原子的核外电子总数是其最外层电子数的3倍,Z原子最外层有1个未成对电子,Q位于Y的不同周期,且它核外成单电子是同周期中最多的,F元素基态原子最外层有1个电子。请回答下列问题:
(1)W、X、Y、Z四种元素中第一电离能最小的是__________(填元素符号);Q原子的价电子排布式为________;
(2)Z元素在周期表中的位置为___________________。
(3)W元素有两种同素异形体, W和X形成的化合物中含有非极性共价键的物质P,写出P与W的最简单氢化物反应的离子方程式__________________
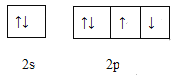
(4)下图是W元素的最外层电子排布图,它违背了电子排布的什么原则____________ 。
(5)Y单质和Z单质反应可生成原子个数比为1:5的化合物M和1:3的化合物N,与M中价态相同的Y的含氧酸根的立体构型为_____________。
(6)写出上问中N的电子式:__________________________
(7)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有____________________________________。
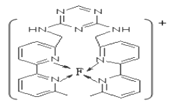
查看答案和解析>>
科目: 来源: 题型:
【题目】SO32-离子的中心原子孤对电子计算公式为(a-xb)/2中,下列对应的数值正确的是
A. a=8 x=3 b=2B. a=6 x=3 b=2
C. a=4 x=2 b=3D. a=6 x=2 b=3
查看答案和解析>>
科目: 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
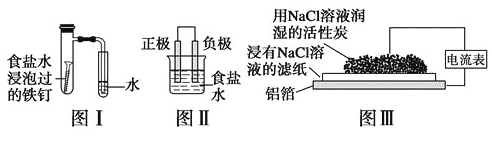
A. 按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B. 图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C. 铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D. 图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com