
科目: 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________________。
(2)反应Ⅲ能够自发进行的条件是__________(填“较低温度”、“ 较高温度”或“任何温度”)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是____。

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率仍位于M
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为_________________;该温度下,反应的平衡常数K=______________L2/mol2;若要进一步提高甲醇体积分数,可采取的措施有____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略): 
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全(Al3+的浓度为10-5mol/L),则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_________________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:___________________________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________________________________________。
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:

若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列问题:
(1)写出下列反应的化学方程式:
①乙烯通入到溴的四氯化碳溶液中:_____________________。
②苯与浓硝酸、浓硫酸混合后加热至50℃~60℃发生反应:__________________。
(2)给下列有机物命名:
①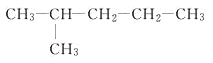 _______________________
_______________________
②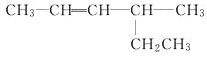 _____________________
_____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】向18.4 g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3 g沉淀。另取等质量的合金,使其与一定量的Cl2恰好完全反应,则Cl2 的体积在标准状况下为
A. 4.48L B. 6.72L C. 7.84L D. 无法计算
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取乙烯并检验乙烯性质的装置如图。请回答有关问题:
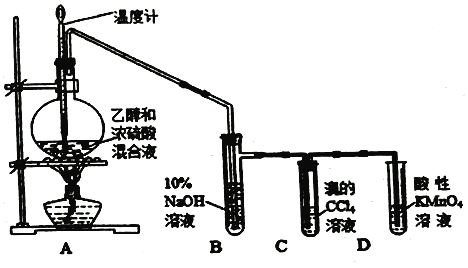
(1)烧瓶中除反应物以外,还应放2-3块碎瓷片,目的是___________。
(2)烧瓶中产生乙烯的反应方程式为____________。
(3)反应开始后,可观察到C和D中共同的现象是___________;C中的反应类型为________、D中的反应类型为____________反应。
(4)反应结束冷却至室温,处理烧瓶中废液发现,反应液变黑、且有强烈的刺激性气味气体,其原因是___________。
(5)10%的NaOH溶液起的作用是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g) ![]() 2HI(g) △H=-a kJ/mol.已知:
2HI(g) △H=-a kJ/mol.已知:
![]() (a、b、c均大于零)。
(a、b、c均大于零)。
下列说法正确的是
A.H2、I2和HI分子中的化学键都是非极性共价键
B.断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C.相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量
D.向密闭容器中加入2 mol H2 (g)和2 mol I2 (g),充分反应后放出的热量为2a kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。利用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中不正确的是

A. 阳极反应式为4OH--4e-=2H2O+O2↑
B. 从A口出来的是硫酸溶液
C. b是阳离子交换膜,允许Na+通过
D. Na2SO4溶液从E口加入
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NO和O2转化为NO2的反应机理如下:
①2NO(g)![]() N2O2(g)(快) △H1<0 平衡常数 K1
N2O2(g)(快) △H1<0 平衡常数 K1
②N2O2(g)+O2(g) ![]() 2NO2化) (慢) △H2<0 平衡常数K2
2NO2化) (慢) △H2<0 平衡常数K2
下列说法正确的是
A. 2NO(g) +O2(g)![]() 2NO2(g)的△H= -(△H1+△H2)
2NO2(g)的△H= -(△H1+△H2)
B. 2NO(g) +O2(g)![]() 2NO2 (g)的平衡常数 K =
2NO2 (g)的平衡常数 K =![]()
C. 反应②的速率大小决定2NO(g)+O2(g) ![]() 2NO2(g)的反应速率
2NO2(g)的反应速率
D. 反应过程中的能量变化可用下图表示

查看答案和解析>>
科目: 来源: 题型:
【题目】无机盐对于维持生物体的生命活动具有重要作用。下列无机盐中,缺乏后会导致哺乳动物血液运输O2的能力下降的是( )
A. Fe2+ B. Mg2+ C. Ca2+ D. Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com