
科目: 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。

查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的△H_______0(填“大于”或“小于”) ;100℃时,体系中各物质浓度随时间变化如上图所示。在0-60s时段,反应速率v(N2O4)为______mol·L-1·s-1;反应的平衡常数K1为________。
(2) 100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a: T______100℃ (填“大于”或“小于”) ,判断理是_______
b:计算温度T时反应的平衡常数K2(要求写出计算过程)__________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向______(填“正反应”或“逆反应”)方向移动,判断理由是__________
查看答案和解析>>
科目: 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列叙述错误的是( )
A. 18gH2O中含有的质子数为10NA
B. 1.0L1.0mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA
C. 46gNO2和N2O4混合气体中含有原子总数为3NA
D. 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有机化合物中,都有多个官能团:
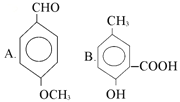
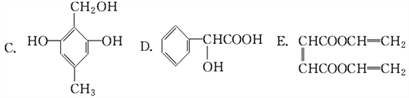
(1)可以看作醇类的是(填入编号,下同)________________。
(2)可以看作酚类的是_________________。
(3)可以看作羧酸类的是_________________。
(4)可以看作酯类的是_________________。
(5)可以看作醛类的是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关氨或铵盐的说法不正确的是( )
A. 可用湿润的红色石蕊试纸检验氨气
B. 用盐酸滴定氨水,当溶液呈中性时,c(NH4+) = c(Cl-)
C. NH3属于弱电解质
D. 常温时,0.1mol·L-1NH4Cl溶液加水稀释,![]() 的值不变
的值不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A. 质子数与中子数相等的硫原子:![]() S B. Al3+的结构示意图:
S B. Al3+的结构示意图:
C. CaO2的电子式:![]() D. 2-溴丙烷的结构简式:C3H7Br
D. 2-溴丙烷的结构简式:C3H7Br
查看答案和解析>>
科目: 来源: 题型:
【题目】关于晶体的下列说法正确的是
A. 六方最密堆积的空间利用率是52%
B. 离子晶体中一定含金属阳离子
C. 在共价化合物分子中各原子都形成8电子结构
D. 分子晶体的熔点可能比金属晶体的熔点高
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组的同学拟用下图所示的装置从含碘废液(除H2O外,还有I2、I-等)中回收碘。回答下列问题:

(1)装置A中发生反应的离子方程式为________。
(2)仪器X的名称为________;装置D的作用是________。
(3)装置C中球形冷凝管冷却水从________(填“a”或“b”)进入,反应控制在较低温度下且保持溶液pH =2进行,其主要原因是________。
(4)三口烧瓶中液体经过滤得粗碘,粗碘可经________(填操作名称)得到纯碘。
(5)为测定某含碘废水中I2的含量,取样l00mL,调节溶液pH后,滴加2滴淀粉溶液,然后用0.02500mol/LNa2S2O3标准溶液滴定,消耗标准液18.15mL。则滴定终点时的现象为________,含碘废水中I2的含量=________mg/mL(结果保留小数点后三位,已知:I2 +2S2O32-=2I-+S4O62-)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:
(1)碳原子的价电子排布图:________________,核外有______种不同运动状态的电子。
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。

①嘌呤中所有元素的电负性由大到小的顺序______________________。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因_________________________________。
③吡啶结构中N 原子的杂化方式___________。
④分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为______________。
)。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为______________。
(3)碳可形成CO、CO2、H2CO3等多种无机化合物。
①在反应CO 转化成CO2 的过程中,下列说法正确的是__________。
A.每个分子中孤对电子数不变 B.分子极性变化
C.原子间成键方式改变 D.分子的熔沸点变大
②干冰和冰是两种常见的分子晶体,晶体中的空间利用率:干冰_______冰。(填“>”、 “<”或“=”)
③H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因___________。
(4)在2017 年,中外科学家团队共同合成了碳的一种新型同素异形体: T- 碳。T- 碳的结构是:将立方金刚石中的每个碳原子用一个由4 个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如下图。已知T- 碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T- 碳的密度的表达式为______________g/cm3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com