
科目: 来源: 题型:
【题目】丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如图所示:

①10.0 g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性。 ③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分。
可能用到的信息:
沸点 | 溶解性 | 着火点(闪点) | 毒性 | |
丙烯酸 | 1420C | 与水互溶,易溶于有机溶剂 | 540C | 有毒 |
甲醇 | 650C | 与水互溶,易溶于有机溶剂 | 110C | 有毒 |
丙烯酸甲酯 | 80.50C | 难溶于水,易溶于有机溶剂 | 不详 | 无毒 |
(注闪点低于500C属于极易燃烧物质)回答下列问题:

(1)仪器c的名称是____________。
(2)混合液用5% Na2CO3溶液洗涤的目的是_____________.
(3)请写出配制100 g 5% Na2CO3溶液所使用的玻璃仪器____________。
(4)关于产品的蒸馏操作(夹持装置未画出),下图中有2处错误,请分别写出_____________、________________________.
为检验产率,设计如下实验:
①.油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5 mol/L的KOH溶液10.00 mL,加热使之完全水解。
②.用酚酞做指示剂,向冷却后的溶液中滴加0.5 mol/L的HCI溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00 mL。
(5)计算本次酯化反应丙烯酸的转化率____。
(6)请列举2条本实验中需要采取的安全防护措施___________________________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】38.4gCu跟适量的浓HNO3反应,Cu全部反应后共收集到气体22.4L(标准状况),反应中作氧化剂的硝酸与总消耗的HNO3的物质的量比( )
A. 5∶11 B. 6∶11 C. 5∶6 D. 6∶5
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将![]() 体积NO和
体积NO和![]() 体积O2同时通入倒立于水中且盛满水的容器中,充分反应后,容器内残留
体积O2同时通入倒立于水中且盛满水的容器中,充分反应后,容器内残留![]() 体积的气体,该气体与空气接触变为红棕色,则
体积的气体,该气体与空气接触变为红棕色,则![]() 为( )
为( )
A. 3:2 B. 2:3 C. 8:3 D. 3:8
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂不可能是 ( )

A. 浓H2SO4B. NaCl溶液C. Ba(OH)2溶液D. NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液能与铝作用生成H2,则溶液中一定可以大量共存的离子组是
A. Cl-、Ba2+、Mg2+、ClO- B. Cl-、SO42-、Cu2+、Mg2+
C. Cl-、SO42-、K+、Na+ D. HCO3-、NO3-、Na+、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M、N、Q 、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:
(1)X元素在周期表中的位置是_______________,它的外围电子的电子排布图为 _______________________________,P元素属于_______区元素。
(2)XZ2分子的空间构型是________ ,YZ2分子中Y的杂化轨道类型为_________ ,相同条件下两者在水中的溶解度较大的是__________(写分子式),理由是_____________________。
(3)含有元素N的盐的焰色反应为____色,许多金属盐都可以发生焰色反应,其原是________________________
(4)元素M与元素Q形成晶体结构如图1所示,设其晶胞边长为a pm,该化合物的摩尔质量为Dg/mol。求该晶胞密度的计算式为_______________g/cm3
(5)三聚氰胺是一种含氮化合物,其结构简式如图2所示。 三聚氰胺分子中氮原子轨道杂化类型是______, 1 mol三聚氰胺分子中 σ键的数目为______。

查看答案和解析>>
科目: 来源: 题型:
【题目】为验证铜与稀硝酸反应的还原产物是NO而不是NO2,设计了如下图的装置,以下叙述错误的是
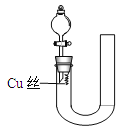
A. 应先打开活塞再从右侧加稀硝酸
B. 左侧稀硝酸须注满
C. 关闭活塞后铜丝会全部溶解
D. 反应停止后打开活塞气体变成红棕色
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)用甲烷与水蒸气制备合成气,每生成1mol合成气,需要供给51.5 kJ热量。该反应的热化学方程式为_____________________________________________________。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),发生反应: CH4(g) + H2O(g) ![]() CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
时间/min 物质的浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
①该反应第一次达平衡时的平衡常数K=_______________。
②3min时改变的反应条件是__________________(只填一种条件的改变即可)。
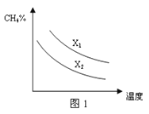
(3)已知一定压强下,温度、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。图1中的两条曲线所示投料比的关系X1 ______X2(填“=”、“>”或“<”)。
Ⅱ.(4)已知常温下HCOOH的电离常数为![]() ,则HCOO—的水解反应HCOO- + H2O
,则HCOO—的水解反应HCOO- + H2O ![]() HCOOH + OH-的平衡常数K h =__________________。
HCOOH + OH-的平衡常数K h =__________________。
(5)常温下,将a mol/L的HCOOH溶液与a/2mol/L的NaOH溶液等体积混合后,溶液中各离子浓度由大到小的顺序是______________________________。
(6)常温下,在a mol/L的HCOOH溶液中加入等体积的bmol/L的NaOH溶液至溶液呈中性,此时溶液中HCOOH的物质的量浓度为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A. 明矾在水中形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. SiO2是良好的半导体材料,常用于制造计算机的芯片
C. Fe2O3俗称铁红,常用作红色的油漆和涂料
D. Cl2可用于自来水的杀菌消毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com