
科目: 来源: 题型:
【题目】四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3、Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:
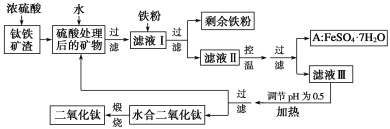
请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是______________________________________。
(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为____________、_______________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。书写水解的离子方程式:_________。
(4)水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_____________。
(5)过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、______(填化学式),减少废物排放。
(6)A可用于生产红色颜料(Fe2O3),其实验方法是:
a.5.56a kg A(摩尔质量为278g·mol-1)溶于水中,加入适量氢氧化钾溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;
b.再向红褐色胶体中加入33.36b kg A和1.12c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;
c.过滤后,沉淀经高温灼烧得红色颜料。
若所得滤液中溶质只有硫酸钾和硫酸铁,则理论上可生产红色颜料__________ kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用0.1 mol/L 的盐酸滴定20.00 mL NaOH溶液,测定其浓度。下列操作正确的是
A. 需用NaOH溶液润洗锥形瓶
B. 用量筒量取20.00 mL NaOH溶液
C. 滴定前,使酸式滴定管尖嘴部分充满盐酸
D. 充分反应后,滴入酚酞溶液,观察是否到达滴定终点
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验原理或操作正确的是
A. 用20mL量筒量取15mL酒精,加水5mL,配制质量分数为75%酒精溶液
B. 在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属离子,则该硫酸盐的物质的量浓度为2.5mol·L1
C. 实验中需用2.0 mol·L1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950mL、201.4g
D. 实验室配制500 mL 0.2 mol·L1的硫酸亚铁溶液,其操作是:用天平称15.2g绿矾(FeSO4·7H2O),放入小烧杯中加水溶解,转移到500 mL容量瓶,洗涤、稀释、定容、摇匀
查看答案和解析>>
科目: 来源: 题型:
【题目】HA 为一元弱酸。已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如图所示。向10 mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。下列说法中,不正确的是

A. pH=9时,c(A-)=c(HA)
B. x=0时,1
C. HA的电离平衡常数ka=10-5
D. x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_________________________。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中均含有的溶质是________(填化学式),写出该溶质的一种用途:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是

A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com