
科目: 来源: 题型:
【题目】铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图甲所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图乙所示。则下列分析正确的是( )

A. 图甲中a点和b点对应物质的化学式分别为Cu2O和CuO
B. 图甲整个过程中共生成0.26 g水
C. 图乙三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A
D. 图甲中,a到b的过程中有0.01 mol电子发生了转移
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出氯碱工业电解饱和食盐水的化学方程式:___________________________
(2)已知:2KMnO4 + 16HCl =2KCl+2MnCl2 +5Cl2↑+8H2O,15.8g KMnO4 与100mL12mol/L浓盐酸充分反应,固体完全溶解,生成标准状况下氯气的体积为________L,转移的电子数为_________个,若向反应后的溶液中加入足量的硝酸银,过滤、洗涤、干燥,可得到固体______g。
(3)将标准状况下6.72L的HCl溶于水形成250mL溶液,取出10mL于锥形瓶中,溶质的物 质的量浓度为______mol/L,向锥形瓶中滴加0.5mol/LBa(OH)2溶液,恰好反应,消耗Ba(OH)2的体积为__________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:

(1)写出铝灰与氢氧化钠溶液反应涉及的化学方程式:_____________________。
(2)图中“滤渣”的主要成分为_______________(填化学式)。
(3)加30%H2O2溶液发生的离子反应方程式为___________________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体是___________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有____________(填化学式)。
③酸性KMnO4溶液紫色变浅_________(填“能”或“不能”)说明煅烧硫酸铝铵晶体产物中含有SO2气体?
理由:_________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,硫化铜矿的湿法冶炼技术已经取得了很大的发展。现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:

反应温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图~如图所示)。

回答下列问题:
(1)火法炼铜的主要反应:①2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(炉渣);
Cu2S+3SO2+2FeO(炉渣);
②2Cu2S+3O2![]() 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S![]() 6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成amolCu,共消耗________molO2。
6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成amolCu,共消耗________molO2。
(2)写出反应1的化学方程式:________________。经查,硫黄、FeSO4·7H2O均可入药,用途广泛,湿法炼铜与火法炼铜相比,优点是_____________________。
(3)从溶液中得到FeSO4·7H2O晶体的操作是_______________________________。
(4)根据实验以及工业生产的实验要求,从下表中得出的最佳工艺条件为________(填字母代号)。

查看答案和解析>>
科目: 来源: 题型:
【题目】一种锂铜可充电电池,工作原理如图所示。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON) 隔开。下列说法不正确的是
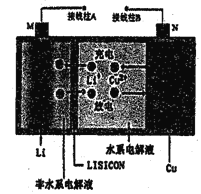
A. 充电时,接线柱A应与外接电源的正极相违
B. 放电时,N为电池的正极
C. 充电时,阴极反应为: Li++e-=Li
D. 陶瓷片允许Li+通过,不允许水分子通过
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 任何晶体中,若含有阳离子也一定含有阴离子
B. 分子晶体中只存在分子间作用力,不含有其他化学键
C. 离子晶体中只含有离子键,不含有共价键
D. 原子晶体中只含有共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】四种易溶于水的强电解质A、B、C、D由以下7种离子组成(电解质中阴离子各不相同)。
阴离子 | Na+ Ba2+ NH4+ |
阳离子 | CH3COO- Cl- OH- SO42- |
已知:①A、C溶液显碱性,A、B的溶液中水的电离程度相同;②C和D的溶液混合反应的现象只是有白色沉淀生成,B和C的溶液混合反应的现象只是有刺激性气味的气体生成,A和D的溶液混合无明显现象。
(1)A是__________,B是_____________。
(2)写出C与D的溶液反应的离子方程式_______________________。
(3)25℃时,0.1mol/LB溶液的pH=a,则B溶液中c(H+)—c(NH3·H2O)=_______________(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合反应后溶液中各种离子浓度由大到小的顺序是______________________。
(5)向用盐酸中和后的C溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br—)/c(Cl—) =_________。(已知Ksp(AgCl) =2.0×10-10,Ksp(AgBr) =5.4×10-13)
查看答案和解析>>
科目: 来源: 题型:
【题目】将KCl和CrCl3两种固体混合物共熔,得化合物X。X由K、Cr、Cl三种元素组成。将1.892gX中的Cr全部氧化成Cr2O72-,Cr2O72-可从过量的KI溶液中氧化出2.667g碘单质(Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O)。向溶有1.892gX的溶液中加入过量的AgNO3溶液,可得4.52gAgCl沉淀。则表示X的化学式为
A. K3Cr2Cl9 B. K3Cr2Cl5 C. K3Cr2Cl7 D. K2CrCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com