
科目: 来源: 题型:
【题目】如图所示,与对应的叙述相符的是

A. 图甲表示反应:4CO(g) +2NO2(g)==N2(g) +4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1<T2,b点处NO2的转化率最大
B. 图乙表示某条件对2A(g) +B(g)==3C(g)的影响,乙一定使用了催化剂
C. 图丙表示的某可逆反应是吸热反应,该图表明催化剂能同时改变正逆反应的活化能
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH>0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH>0
查看答案和解析>>
科目: 来源: 题型:
【题目】反应N2O4(g)2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是
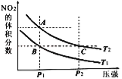
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. A、B两点气体的平均相对分子质量:A>B
D. B、C两点化学平衡常数:B<C
查看答案和解析>>
科目: 来源: 题型:
【题目】以下是由乙烯合成乙酸乙酯的几种可能的合成路线:

(1)乙酸中官能团的结构简式是___。
(2)请写出反应涉及到的化学反应类型___________。
(3)请写出⑤反应的化学方程式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜板腐蚀剂。
(1)补全FeCl3溶液腐蚀印刷电路铜板的离子方程式(并配平):Fe3++ Cu=___________。
(2)将以上反应设计成原电池,写出电极反应式。正极反应___________;负极反应___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO![]() →Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,则得到I2最多的是( )
→Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,则得到I2最多的是( )
A. Fe3+ B. MnO![]() C. Cl2 D. HNO2
C. Cl2 D. HNO2
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家研究以太阳能为热源分解Fe3O4,最终循环分解水制H2,其中一步重要反应为:2Fe3O4(s)![]() 6FeO(s)+O2(g) △H=a kJ/mol。在一定压强下, Fe3O4的平衡转化率随温度变化的a(Fe3O4)―T曲线如图所示。下列有关说法不正确的是
6FeO(s)+O2(g) △H=a kJ/mol。在一定压强下, Fe3O4的平衡转化率随温度变化的a(Fe3O4)―T曲线如图所示。下列有关说法不正确的是
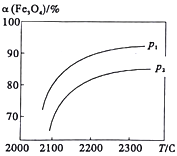
A. a>0
B. 压强p1>p2
C. 升高温度,该反应的平衡常数增大
D. 将体系中O2分离出去,能提高Fe3O4的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式不正确的是
A. 用硝酸银溶液检验自来水中的氯离子:Ag++Cl-=AgCl↓
B. 实验室用碳酸钙与稀盐酸反应制备二氧化碳:CO32-+2H+=H2O+CO2↑
C. 用稀硫酸清洗铁锈(氧化铁):Fe2O3+6H+=2Fe3++3H2O
D. 用MnO2和浓盐酸反应制备Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,属于消去反应的是( )
A. 苯与Fe、Br2混合B. 氯乙烷和NaOH溶液共热
C. 乙醇与乙酸反应生成乙酸乙酯D. 乙醇与浓硫酸共热到170℃
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中NH3的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2和H2的转化率之比均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成NH3的物质的量最多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com