
科目: 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的电子排布图为_______________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可发生银镜反应。A中存在化学键的类型是______;
A.离子键 B.极性键 C.非极性键 D.σ键 E.π键
B分子官能团中碳原子的轨道杂化类型是____。
(3)用“>”或“<”填空:
第一电离能 | 熔点 |
b___d | dc2晶体___d晶体 |
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子,e元素位于元素周期表的_______区。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,加入乙醇可析出深蓝色晶体,请书写析出晶体的离子方程式___________________。
(6)e单质为面心立方晶体,其原子半径为rcm,其晶胞棱长为a nm,则e单质的密度为__________g·cm-3,其空间利用率的计算式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态碳原子中,核外存在______对自旋相反的电子。
(2)碳是形成化合物种类最多的元素:常见的有机物CH3COOH中c原子轨道杂化类型为___________,乙酸中官能团的名称为__________________。
(3)碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
①金刚石、石墨烯(指单层石墨)中C-C键夹角大小为石墨烯________金刚石(填“>”或“<”)。
②已知金刚石里C-C键长为154pm,石墨里C-C键长为142 pm,C60、石墨、金刚石熔点从高到低的顺序为______________________;其中石墨与金刚石熔点高低顺序的原因为:_____________________________________________。
③一个金刚石晶胞含有_______个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=_________a。
④石墨晶胞如图虚线所示,切出来的晶胞如图所示,则一个石墨晶胞含有碳原子个数为_________,已知石量的密度为ρg/cm3,层内的碳原子核向距为dcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距为_________cm。(C的相对原子质量为12)
查看答案和解析>>
科目: 来源: 题型:
【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】钠与水反应的实验过程如图①、②、③所示,下列有关说法不正确的是
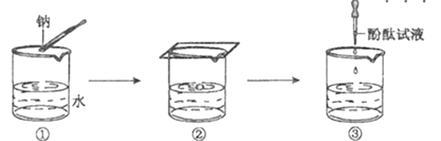
A. 图②中钠熔成小球,说明钠与水反应放热且钠的熔点低
B. 图②中钠四处游动并嘶嘶作响,说明反应产生了气体
C. 图③中滴加酚酞试液后溶液变红,说明有碱性物质生成
D. 钠与水反应的离子方程式是: 2Na+ 2H+=2Na+ + H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】用钒钛磁铁矿为原料冶炼铁,产生一种固体废料,主要成分如下表。

通过下列工艺流程可以实现元素Ti、Al、Si的回收利用,并得到纳米二氧化钛和分子筛。

请回答下列问题:
(1)步骤①②③中进行分离操作的名称是____,
(2)下列固体废料的成分中,不属于碱性氧化物的是____(填字母序号)。
a. TiO2 b.MgO c.SiO2 d.CaO
(3)熔融温度和钛的提取率关系如下图,适宜温度为500℃,理由是____。

(4)滤液①中溶质的成分是____。
(5)步骤②中发生反应的离子方程式是 ___。
(6)将步骤③中制取分子筛的化学方程式补充完整:______
![]()
根据成分表中数据,计算10 kg固体废料,理论上应再加入Na2 Si03物质的量的计算式是n( Na2SiO3)=____mol(摩尔质量/g/mol :SiO2 60 Al2O3 102)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知由金属钠制得氧化钠,可用多种方法:a.4Na+O2===2Na2O,b.4Na+CO2===2Na2O+C,c.2NaNO2+6Na===4Na2O+N2↑。
①在上述三种方法中,最好的方法是________(填序号),原因是________________。
②上述反应c中NaNO2作________剂,当有1 mol NaNO2反应时,电子转移的数目是________________________________________________________________________。
(2)现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下。回答下列问题(注:Na2O2可以与H2O、CO2反应):
①装置Ⅳ中盛放的药品是________,其作用是____________________________。


②若规定气体的气流方向从左到右,则组合实验装置时各仪器接口的标号字母(a、b……)顺序:空气进入________,________接________,________接________,________接________。
③装置Ⅱ的作用____________________________________________________。
④操作中通空气和加热的顺序为________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 向鸡蛋清的溶液中加入浓的硫酸钠溶液或福尔马林,蛋白质的性质发生改变并凝聚
B. 将牛油和烧碱溶液混合加热,充分反应后加入食盐水,上层析出甘油
C. 氨基酸分子中都含有—COOH和—NH2 ,种类较多,为高分子化合物
D. 淀粉、纤维素、麦芽糖在一定条件下可和水作用转化为葡萄糖
查看答案和解析>>
科目: 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镲、硒、硅等化学物质。
(1)基态铜原子有________种运动状态不同的电子,核外电子占据最高能层的符号是__________,占据该能层电子的电子云轮廓图形状为____________________;
(2)①硒、硅均能与氢元素形成气态氢化物。则它们形成的组成最简单的氢化物的分子构型分别为______________、_______________。
②若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为 Se___Si(填“>”或“<”)。
③人们把硅与氢元素形成的一类化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是________________________________________。
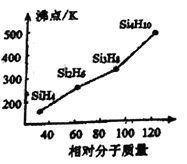
③与铟、镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为________________,B与N之间形成_________键。
(4)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。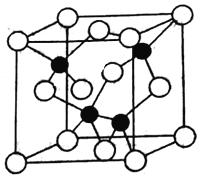
已知砷化镓的晶胞结构如图所示,则砷化镓的化学式为____________,AS和Ga之间的化学键为________和_________。砷化镓密度为ρg·cm-3, Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为______________(用含有ρ、NA等符号的式子表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目______________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______MnO4-+______Fe2++______H+=______Mn2++______Fe3++______H2O。
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】高中化学学习过程中的物质颜色是需要注意的。下列关于颜色的描述正确的个数是
①AgBr见光分解会生成浅黄色的银
②KI溶液中加入淀粉溶液会变成蓝色
③溴水中加入CCl4振荡静置后,CCl4层无色
④钾元素的焰色反应透过蓝色的钴玻璃观察呈紫色
A.1个B.2个C.3个D.4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com