
科目: 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述正确的是

A. a和b不连接时,铁片上会发生氧化反应而质量减少
B. a和b用导线连接时,铜片上发生的反应为:Cu-2e-===Cu2+
C. 无论a和b是否连接,铁片均会被氧化,溶液均有Fe2+生成
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质用途的说法正确的是()
A. 二氧化硅是生产光纤制品的基本原料
B. 水玻璃可用于生产黏合剂和防火剂
C. 高锰酸钾可用于医药上消毒剂
D. 碳酸钠可用于洗涤剂
查看答案和解析>>
科目: 来源: 题型:
【题目】I、焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式______________________________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:

①pH=4.1时,Ⅰ中为__________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
(3)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L-1(以SO2计)。
II、高铁酸钾是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
![]()
(1)①高铁酸钾中铁元素的化合价为________。
②其中第一步操作是:在NaClO溶液中加入烧碱固体形成强碱性环境,将研磨过的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1 h。发生的离子反应如下:(____)Fe3++ ( ) ClO-+ ( )[ ]==( ) FeO42-+( )Cl-+( ) H2O,完成并配平上述反应的化学方程式。
(2) 高铁酸钾和水发生反应,生成物能吸附杂质净水,同时还产生气体,写出反应的离子方程式:_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后(盐酸有剩余),再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
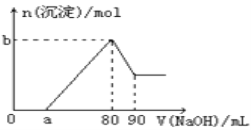
A. 盐酸的体积为80mL
B. a的取值范围为0<a<50
C. 当a值为30时,b值为0.01
D. n(Mg2+)<0.025mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,按单质、化合物、混合物顺序排列的是( )
A.天然气 酒精 液态氯化氢B.稀有气体 浓硫酸 纯碱
C.水银 氢氧化钙 民用管道煤气D.金刚石 铁矿石 大理石
查看答案和解析>>
科目: 来源: 题型:
【题目】榴石矿石可以看作CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下:

(1)用方程式表示盛放氢氧化钠溶液的试剂瓶不能用玻璃塞的原因________;
(2)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有_______________;
(3)步骤③中NaOH参加反应的离子方程式是________________,鼓入空气并充分搅拌的目的是_____________________。
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是___________;写出步骤④通入过量CO2的离子方程式 _________________________________。
(5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Cu2+、 CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)

下列说法不正确的是
A. 原溶液一定存在CO32-和SO42-,一定不存在Cu2+
B. 原溶液一定存在Cl-,可能存在Na+
C. 原溶液中c(Cl-) ≥0.1mol·L-1
D. 若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列陈述I、Ⅱ正确并且有因果关系的是 ( )
选项 | 表述I | 表述II |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | ClO2有强氧化性 | ClO2可用于自来水消毒 |
C | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
D | NH3·H2O具有碱性 | NH3可使干燥的蓝色石蕊试纸变红 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】①已知t ℃时AgCl的Ksp=2×10-10;②Ag2CrO4是一种橙红色的固体。在t ℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A. 在t℃时,用AgNO3标准溶液滴定20mL未知浓度的KCl溶液,可以采用K2CrO4溶液为指示剂
B. 在饱和Ag2CrO4溶液中加入K2CrO4固体可使溶液由Y点到X点
C. 在t ℃时,以0.01 mol·L-1 AgNO3溶液滴定20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液, CrO42-先沉淀
D. 在t ℃时,反应Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+ CrO42- (aq)的平衡常数K=2.5×105
2AgCl(s)+ CrO42- (aq)的平衡常数K=2.5×105
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com