
科目: 来源: 题型:
【题目】化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:__________________;
(2)实验中需加热至恒重的目的是:_________________________;
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_________________;
(2)实验中判断沉淀是否完全的方法是_______________________________。
方案三:按如图装置进行实验:

(1)B装置内所盛试剂是__________ 分液漏斗中____________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为____________________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】若原子的最外层电子排布为ns1的元素R的叙述正确的是
A. 一定是ⅠA族元素
B. 一定是金属元素
C. 可能不是金属元素也可能是非金属元素
D. 不是ⅡA族元素就是副族元素
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 分子晶体中一定存在分子间作用力,不一定存在共价键
B. 分子中含两个氢原子的酸一定是二元酸
C. 非极性分子中一定含有非极性键
D. 元素的非金属性越强,其单质的活泼性一定越强
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1﹕1﹕1时,实际参加反应的FeS与HNO3的物质的量之比为____________。
(2)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为____________mol。
(3)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是___________mL。
(4)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:

Co(OH)3溶解还原反应的离子方程式为_______________________________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处 SO42-从右向左移动.下列分析正确的是

A. 溶液中c(A2+)增大
B. B的电极反应:B→B2++2e-
C. y电极上有氢气产生,发生还原反应
D. 反应初期,x电极周围出现白色胶状沉淀,随后沉淀也不会溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是

A. N极是负极
B. 该装置工作时,H+从右侧经阳离子交换膜移向左侧
C. 负极的电极反应为:(C6H10O5)n+7H2O﹣24e﹣═6CO2↑+24H+
D. 物质X是OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe 及少量Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:
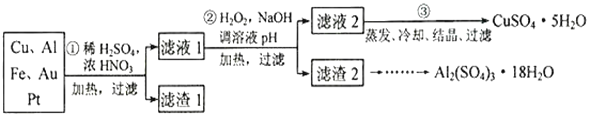
请回答下列向题:
(1)第①步Cu与酸反应的离子方程式___________________,得到滤渣1的主要成分为_________。
(2)第②步加H2O2的作用是做氧化剂,将溶液中的Fe2+离子氧化为Fe3+,写出该反应的离子方程式_______________________________,用H2O2做氧化的优点是__________________。
(3)滤渣2的主要成分中Al(OH)3和Fe(OH)3在生产中如何分离两种沉淀,写出反应的离子方程式:_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )

A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是常见的电化学装置图,①③④中均为惰性电极,下列说法不正确的是

A. 装置①中正极反应式为:2Cl--2e-=Cl2,负极反应式为:Cu2++2e-=Cu
B. 装置②中铜片为阳极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol电子转移,此时此时铜片和铁制品的质量差128g
C. 装置③中b极为正极,该极的电极反应方程式为O2+2H2O+4e-=4OH-
D. 装置④阴极的纯水中加入NaOH的作用是:增大离子浓度,增强溶液的导电性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com