
科目: 来源: 题型:
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R 表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气。

请回答下列问题:
(1)写出各物质的化学式:A________;B________;C________;D________;E________。
(2)写出反应①的化学方程式:______________________________________,该反应中氧化剂与还原剂的物质的量之比为________。
(3)写出反应④的离子方程式:______________________________________。
(4)写出反应⑤的离子方程式:______________________________________。
(5)H2CO3的酸性强于E的,请用离子方程式予以证明:________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:

回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______________________________g·cm-3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为________nm。
所形成的正八面体的体心,该正八面体的边长为________nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱。
[提出假设] 假设1:Fe2+还原性比I-强。
假设2:I-还原性比Fe2+强。
[验证假设] 选择几种装置进行实验:

(1)实验必需的装置是A→____________(按Cl2气流方向的顺序填写)。
(2)实验开始后,控制通入氯气的量,当通入少量氯气时,通过观察混合溶液颜色的变化________(填“能”或“不能”)判断反应的先后顺序。
(3)请在下表中写出实验步骤及预期现象和结论________、________、________、________、_______、________。

(4)为了实验成功,必须控制各物质的量。该小组称取1.52g FeSO4固体,同时称取1.66g KI固体,溶于水中配成混合溶液。为了验证上述假设,通入的Cl2体积最多不能超过________L(标准状况)。
[思考与交流]
(5)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序。于是提出另一方案:往KI溶液中滴入________溶液,如果能发生反应,即可证明I-的还原性强于Fe2+。
查看答案和解析>>
科目: 来源: 题型:
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
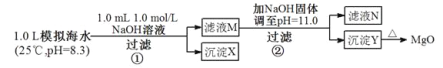
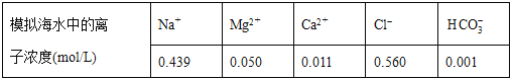
注:溶液中某种离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A. 沉淀物X为CaCO3
B. 滤液M中存在Mg2+,不存在Ca2+
C. 滤液N中存在Mg2+,Ca2+
D. 步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池)。下列有关说法不正确的是

A. 放电时正极反应为:NiOOH+H2O+e-===Ni(OH)2+OH-
B. 充电时负极反应为:MH+OH-===H2O+M+e-
C. 电池的电解液可为KOH溶液
D. MH是一类储氢材料,其氢密度越大,电池的能量密度越高
查看答案和解析>>
科目: 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32﹣和SO42﹣,一定不存在Fe3+
B. 原溶液一定存在Cl﹣,可能存在Na+
C. 原溶液中c(Cl﹣)≥0.1molL﹣1
D. 若原溶液中不存在Na+,则c(Cl﹣)<0.1molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2, 所得溶液 pH 变化如图所示。下列分析中,正确的是( )

A. ab 段反应是:SO2+ 2 H2S="3S↓+2" H2O
B. 亚硫酸是比氢硫酸更弱的酸
C. 原H2S溶液的物质的量浓度为0.05 molL-1
D. b 点对应的溶液导电性最强
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验中的说法正确的是
A. 将碘水倒入分液漏斗中,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B. 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C. 某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO![]()
D. 加浓溴水然后过滤可以除去苯中少量的苯酚
查看答案和解析>>
科目: 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式如图,下列有关说法正确的是

A. 该物质中苯环上一氯代物有2种
B. 1 mol该物质可以与1.5 mol碳酸钠溶液反应生成1.5 mol CO2
C. 1 mol该物质可以和4 mol浓溴水发生反应
D. 所有碳原子不可能都在同一个平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com