
科目: 来源: 题型:
【题目】下列反应中,属于氧化还原反应且属于离子反应的是
A. 2Na2O2+2CO2 = 2Na2CO3+O2 B. CO2+Ca(OH)2== CaCO3↓+H2O
C. Fe2O3+3CO![]() 2Fe+3CO2 D. 2Na+2H2O==2NaOH+H2↑
2Fe+3CO2 D. 2Na+2H2O==2NaOH+H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】现用98%浓硫酸(密度1.84 g·cm3)配制浓度为0.5 mol·L1稀硫酸500mL.
(1)选用的主要仪器有:_________、________、__________、_______、
__________;
(2)请将下列操作按照正确的序号填在横线上___
A.用量筒量取浓硫酸
B.反复颠倒摇匀
C.用胶体滴管加水至刻度
D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶
E.稀释浓硫酸
F.将溶液转入容量瓶
(3)所需浓硫酸的体积为______mL.
(4)将浓硫酸沿着烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是______;若搅拌过程中有液体溅出,会使最终结果______(填偏高、偏低或无影响)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列方框中对应的物质或有关叙述正确的是( )
![]()
A. Na2S4O6、H2O、Na2S2O3、Au2O、NaOH B. Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C. Na2S2O3、H2O、Na2S4O6、Au2O、NaOH D. 当1 mol Au2O3完全反应时,转移电子8mol
查看答案和解析>>
科目: 来源: 题型:
【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构的相关知识去认识和理解。
(1)H+可与H2O形成H3O+,H3O+ 立体构型为_________。H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为_________________________________________。
(2)COCl2的空间构型为____________;溴的价电子排布式为________________。
(3)根据已经掌握的共价键知识判断,键的极性F-H _______ O-H(“>”,“=”或“<”)
(4)溴化碘和水反应生成了一种三原子分子,该分子的结构式为____________________ ,中心原子杂化轨道类型为________________。
(5)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是________。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(6)下列分子既不存在sp σ键,也不存在pp π键的是________。
A.HCl B.HF C.SO2 D.SCl2
(7)ClO2-立体构型为____________,写出与ClO2-互为等电子体的一种分子为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有6种不同运动状态的电子 |
C | 基态原子中s电子总数与p电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为3s23p1 |
F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1)A元素位于元素周期表第_______周期_______族;C元素和F元素的电负性比较,较小的是________。
(2)D的单质在空气中燃烧时火焰的颜色是__________________,请用原子结构的知识解释发光的原因:__________________________。
(3)H元素位于元素周期表的_________区。基态E原子的L层电子排布图为__________。
(4)B元素与宇宙中含量最丰富的元素形成的最简单化合物的VSEPR模型为________,B元素与同周期相邻两元素的电离能大小关系为______________ , 请解释原因__________________________________。
(5)G元素的低价阳离子的离子结构示意图是________,F元素原子的价电子的电子排布图是________。
(6)在基态G中,电子占据的最高能层符号为________,该能层具有的原子轨道数为____________。
(7)G的高价阳离子的溶液与H单质反应的离子方程式为___________________________;
(8)与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的离子方程式:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4N3(叠氮化铵)易发生爆炸反应: NH4N3![]() 2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
A. 1.8gNH4+中含有的质子数为1NA
B. N2既是氧化产物,又是还原产物
C. 爆炸反应中,当转移4NA个电子时,产生89.6L (标准状态)混合气体
D. 6g的NH4N3晶体中含有的阴离子个数为0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,负极材料采用Pt,正极材料采用MnO2(既作电极材料又对该极的电极反应具有催化作用),该电池可用作卫星、深水勘探等无空气环境电源,其工作原理如图所示。下列说法不正确的是
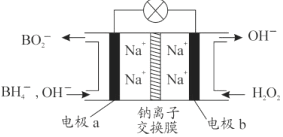
A. 每消耗3mol H2O2,转移6mol e﹣
B. 电池工作时Na+从b极区移向a极区
C. a极上的电极反应式为:BH4﹣+8OH﹣﹣8e﹣═BO2﹣+6H2O
D. b极材料是MnO2,该电池总反应方程式:NaBH4 + 4H2O2===NaBO2 + 6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。

请问答下列问题:
(1)反应①﹣⑤中,既属于氧化还原反应又属于化合反应的是_____(填序号)
(2)反应⑤的化学方程式为_______________________________________
(3)甲与B反应的离子方程式________________________________________
(4)在实验室将C溶液滴入F溶液中,观察到的现象是____________________________________
(5)在F溶液中加入等物质的量的A,A体现的性质为_____________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化铝的熔点很高,常用于制造耐火材料,例如制作坩埚。下列操作不能在氧化铝坩埚中进行的是
A.加热使胆矾失去结晶水B.加热使高锰酸钾分解
C.加热熔化烧碱D.加热分解碱式碳酸铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com