
科目: 来源: 题型:
【题目】下列依据实验操作及现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3 > C12 |
C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列结论错误的是 ( )

A. 完全电解2 mol H2O断裂的σ键键数为4NA
B. 标准状况下,11.2 L CO2中含有的π键键数为2NA
C. 60 g SiO2晶体中含有的Si—O键键数为4NA
D. 128 g金属铜中含有如图所示的晶胞数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如果1mol金刚石的质量为a g,密度为ρg·cm﹣3,请计算出每个碳原子的共价半径________(两个原子核之间距离的一半)(设碳原子为紧密堆积结构,见图)。(用含a,ρ,NA的式子表示。NA表示阿伏加德罗常数的值)

查看答案和解析>>
科目: 来源: 题型:
【题目】H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸)。
(1)实验室可用硫化亚铁固体与稀硫酸反应来制备H2S气体。
①该反应的化学方程式为____________________________。
②多余的H2S气体可用_____________溶液来吸收,不能用燃烧的方法处理H2S气体的理由是___________。
(2)用30% FeCl3溶液作吸收液也能吸收H2S气体,反应方程式为:2FeCl3+H2S = S↓+2FeCl2+2HCl,废吸收液经电解可循环使用。
①该反应中H2S显__________(填字母)。
a、不稳定性 b、弱酸性 c、氧化性 d、还原性
②检验废吸收液中是否含有Fe3+的适宜试剂是___________。
③强酸性的废吸收液电解可生成FeCl3和一种分子量最小的气体,则化学方程式为____________。
(3)已知:H2S在高温下分解生成硫蒸气和H2。现测得某温度下,H2S分解过程中各物质的物质的量随时间变化关系如图所示。
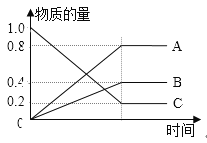
①表示H2的曲线是__________(填“A”、“B”或“C”)。
②生成硫蒸气的分子式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙(由6个球体所围成的空隙。6个球体中心的连线连接成八面体形状),一种由镍原子构成,另一种由镍原子和镁原子一起构成,两种八面体的数量比是1︰3,碳原子只填充在镍原子构成的八面体空隙中。
(1)镍的外围电子排布式为________________。
(2)画出该新型超导材料的一个晶胞。(镁原子处于晶胞的顶点。碳原子用▲球,镍原子用○球表示)_______。
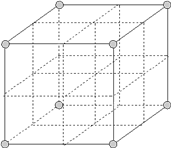
(3)写出该新型超导材料的化学式_____________。
(4)镍原子的配位数是_____________。
(5)原子坐标参数表示晶胞内部各原子的相对位置,用(0,0,0)表示镁原子的原子坐标,晶胞边长设为1,则碳原子的原子坐标参数为_____________。
(6)已知晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,阿伏加德罗常数的数值为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求表达下列变化过程中的化学用语,其中⑴~⑶写化学方程式,⑷~⑸写离子方程式。
(1)金属镁在CO2中燃烧__________________________________________
(2)加热碳酸氢钠固体____________________________________________
(3)二氧化硫与氢氧化钠溶液反应__________________________________
(4)KCl溶液与AgNO3溶液反应_____________________________________
(5)铜与稀硝酸反应制取NO气体____________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价电层电子均已成对。
回答下列问题:
(1)E2+的外围电子排布图为________________。
(2)五种元素中电负性最小的是________(填元素符号),CAB-离子中,A原子的杂化方式是________。
(3)AB-、D+和E2+三种离子组成的化学物质D2E(AB)4,该化合物中存在一个复杂离子,该离子的化学式为________,配位体是________。
(4)C和E两种元素组成的一种化合物的晶胞如图所示。
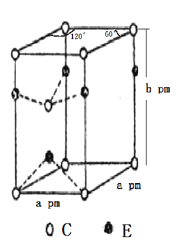
①该化合物的化学式为________,E的配位数为________,C采取________(填“简单立方”、“体心立方”、“六方最密”或“面心立方最密”)堆积;
②列式表示该晶体的密度:________g·cm-3。(NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目: 来源: 题型:
【题目】某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2→4LiCl+S+SO2,下列有关判断正确的是(提示:SOCl2中S显![]() 价)
价)
A. 还原剂只有Li
B. SOCl2既是氧化剂又是还原剂
C. 还原产物包括LiCl和S
D. 生成1.12LSO2时,反应转移电子为0.2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。
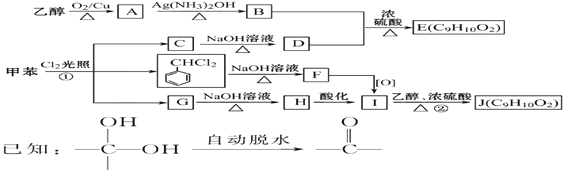
请回答:
(1)①的反应类型为_________________; J的官能团名称是_______________;
(2)D的化学名称是_________________________, F的结构简式为__________________________。
(3)写出下列反应方程式
①乙醇→A: ________________________________________________________。
② C→D:________________________________________________________。
③B+D→E: _____________________________________________________。
④G→H:________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com