
科目: 来源: 题型:
【题目】材料与化学密切相关,表中对应关系错误的是
材料 | 主要化学成分 | |
A | 刚玉、金刚石 | 三氧化二铝 |
B | 大理石、石灰石 | 碳酸钙 |
C | 普通水泥、普通玻璃 | 硅酸盐 |
D | 沙子、石英 | 二氧化硅 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A.Na2O2、CaO、K2O都是碱性氧化物B.BaSO4、NaCl、KNO3溶液都是电解质
C.纯碱、烧碱、碱石灰都是碱D.稀豆浆、果冻、淀粉溶液都是胶体
查看答案和解析>>
科目: 来源: 题型:
【题目】钒和钛金属的性能都很优越,在航空航天领域用途广泛。回答下列问题:
(1)钛元素基态原子的电子排布式为______________,未成对电子数为_______________个。
(2)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是_____________(填元素符号),中心原子的化合价为_____________;配体之一H2O2中氧原子杂化类型为__________,H2O2分子中氧原子的价层电子对互斥模型是______________。
(3)单质钒及钛都是由______________键形成的晶体,己知金属钛是六方最密堆积,金属钒是体心立方堆积,则__________(填“钛”,或“钒”)的空间利用率较大。
(4)碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图所示。
 (小球为V原子)
(小球为V原子)
①晶胞中碳原子与钒原子的数量比为____________。
②该晶胞中与碳原子距离最近且相等的碳原子个数为_____________。
③若合金的密度为dg· cm-3,晶胞参数α=______nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是

A. a为Cl2气体,b为饱和NaCl溶液
B. a为NH3气体,b为盐酸溶液
C. a为CO2气体,b为浓NaOH溶液
D. a为HCl气体,b为H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在研究Fe与H2SO4的反应时,进行了如下实验。
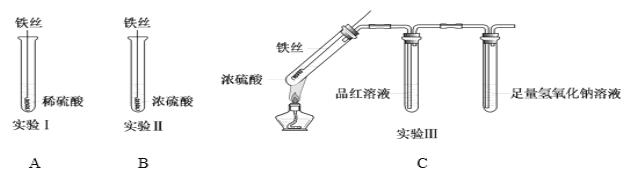
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为__________________________________。
(2)实验Ⅱ中,铁丝表面迅速变黑,反应很快停止,其原因是________________________________。
(3)实验Ⅲ中,加热后产生大量气体,中间试管中品红溶液的红色褪去,最终未检测到可燃性气体。最后装NaOH溶液试管中反应的离子方程式是_________________________________。
(4)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同。浓硫酸的氧化性源于+6价的硫元素,稀硫酸的氧化性源于______。
②造成反应多样性的主要因素有________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到固体TiO2。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为______________________
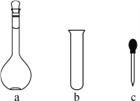
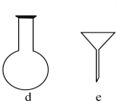
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是:____________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号)。
(3)滴定终点的现象是________________________________________。
(4)检验TiO2·xH2O中Cl-是否被除净的方法是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种清洁高效能源,以甲醇为原料可以制取氢气。回答下列问题:
(1)甲醇水蒸气重整制氢
主反应:①CH3OH(g)![]() CO(g)+2H2(g) ΔH =+90.7kJ/mol
CO(g)+2H2(g) ΔH =+90.7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH =-41.2 kJ/mol
CO2(g)+H2(g) ΔH =-41.2 kJ/mol
副反应:③CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH =+206.3 kJ/mol
CH4(g)+H2O(g) ΔH =+206.3 kJ/mol
则甲醇水蒸气重整制氢反应(反应Ⅰ):CH3OH(g) +H2O(g)![]() CO2(g)+3H2(g)的 ΔH=_________。反应②中lmolCO与lmol水蒸气反应的的活化能为E1kJ,则该反应生成物的活化能为_________kJ。
CO2(g)+3H2(g)的 ΔH=_________。反应②中lmolCO与lmol水蒸气反应的的活化能为E1kJ,则该反应生成物的活化能为_________kJ。
(2)实验室模拟甲醇水蒸气重整制氢过程,合成器组成n(CH3OH):n(H2O) =1:1时,体系中甲醇的平衡转化率与温度和压强的关系如图所示。

①该反应的平衡常数表达式为_______________。
②当温度为250℃、压强为P2时,反应达平衡时H2的体积分数为______________。
③图中的压强由小到大的顺序是________________。
④根据主副反应分析,氢气的产率随压强的增大而___________,其原因是__________________。
(3)MFC30氢氧燃料电池是以碳酸盐为电解质(提供CO32-)的高温型燃料电池,负极的电极反应式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组在验证反应“2Fe3+ + Cu =2Fe2+ + Cu2+”的实验中观察到溶液颜色由棕黄色变为浅绿色,且产生灰白色沉淀。发现和探究过程如下。
实验过程 | 实验现象 | |
实验1 |
| 充分振荡,棕黄色溶液逐渐变浅,最后呈浅绿色,有灰白色固体产生 |
实验1中所得溶液的颜色比预期的浅,针对其原因进行探究。
(1)甲认为:实验后,溶液中c (Cu2+)应为0.5 mol/L。“溶液颜色浅”是c (Cu2+)低于0.5 mol/L造成的。 配制含0.5 mol/L CuCl2和____________mol/L FeCl2混合溶液,观察溶液的颜色。该溶液为蓝绿色,明显比实验所得溶液颜色深,说明_________________________。
(2)甲进一步研究认为,“溶液颜色浅”与产生了灰白色固体有关。
甲查阅资料如下,猜想灰白色固体可能含有CuCl。
资料:CuCl是白色固体,不溶于水、硫酸,可溶于氨水。
为探究灰白色固体成分,设计实验方案如下:
方案1 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入过量稀硝酸,如果有白色固体剩余,则证明有CuCl |
方案2 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入浓氨水浸泡,过滤,向滤液中加入稀硫酸 |
a.按方案1进行实验2:
b.加入稀硝酸的目的是___________,反应的离子方程式是____________________________________。
c.乙认为该方案不严谨,理由是:CuCl具有还原性,被硝酸氧化后的生成物能溶于稀硝酸。
d.按方案2进行实验3:
e.加入稀硫酸时,产生的实验现象是____________,说明灰白色固体中含有CuCl。
(3)综合上述实验,说明实验1所得溶液的颜色比预期浅的原因是_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com