
科目: 来源: 题型:
【题目】在浓硝酸中放入铜片:
(1)反应开始的化学方程式为_________________________________________;
(2)根据上述实验现象,表明硝酸具有_____________填序号;
①酸性 ②不稳定性 ③强氧化性
(3)用V L的试管装满NO2气体,并倒扣在足量的水中,待试管中液面不再上升时,试管中溶液的浓度为_____________;(气体摩尔体积用Vm表示)
(4)待反应停止时,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,其原因是________________________________________离子方程式;
(5)若将12.8g铜跟一定质量的浓硝酸反应,铜耗完时,共产生气体5.6L标准状况,则所消耗的硝酸的物质的量是_____________,反应中转移的电子的物质的量为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液470 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是____(填序号),配制上述溶液还需用到的玻璃仪器是____ (填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有___________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1 mol·L-1(填“大于”“等于”或“小于”)。
(4)根据计算可知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式______________________________________;
(2)在实验室中,还可以用浓氨水与____________(填写一种试剂)快速制取少量氨气;
(二)该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
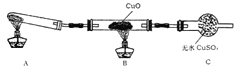
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是____。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式:_________________________
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ ![]() Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O_______________________________________________。
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O_______________________________________________。
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72g。据此可推得,A的化学式为____________。由此,得到的结论是:________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知草酸(H2C2O4)可使H2SO4酸化的KMnO4溶液褪色,请回答以下问题:
①请补全并配平该反应方程式:
_____H2C2O4+___KMnO4+___H2SO4 → ___K2SO4+____ MnSO4+___ CO2↑ + ___H2O
②在该反应还原产物为________(写化学式)
(2)某溶液中可能含有以下离子:Na+、K+、Fe3+、CO32-、SO42-、Cl-,现进行如下实验:

根据实验现象回答:
该溶液中一定含有的离子是______________;一定不含有的离子是____________;无法确定的离子是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】知在稀硫酸中,KBrO3和KI能发生以下反应(均未配平):BrO3—+H++I—![]() IO3—+Br2+H2O IO3—+H++ Br—
IO3—+Br2+H2O IO3—+H++ Br—![]() Br2+I2+H2O
Br2+I2+H2O
(1)试比较在酸性条件下BrO3—、Br2、IO3—、I2氧化性的强弱:_____>_____>_____>_____。
(2)配平下列反应的离子方程式:_____BrO3—+_____H++_____I—![]() _____I2+ _____Br—+_____H2O,反应中的氧化剂是_____________;被氧化的元素是______________。
_____I2+ _____Br—+_____H2O,反应中的氧化剂是_____________;被氧化的元素是______________。
(3)以下离子方程式错误的是______________(选填答案编号)。
a.6I-+ BrO3-+ 6H + → 3I2 + Br-+ 3H2O
b.IO3-+ Br-→I-+ BrO3-
c.5I-+ 6BrO3-+ 6H + →3 Br2+ 5 IO3-+ 3H2O
d.5I-+ 2BrO3-+ 6H + → Br2 + IO3-+ 2I2 + 3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】向仅含 Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如下图所示。下列说 法中正确的是
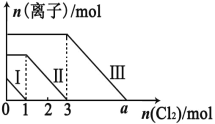
A. 线段Ⅲ代表 Fe2+的变化情况
B. 线段Ⅰ代表 Br -的变化情况
C. 原混合溶液中 n(FeBr2)=4mol
D. a 数值等于 6
查看答案和解析>>
科目: 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】FeS 与一定浓度的HNO3 反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1:1:2 时,实际参加反应的FeS 与被还原的HNO3的物质的量之比为 ( )
A. 1:4 B. 1:5 C. 1:6 D. 1:7
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质所对应的化学式不正确的是( )
A. 硫化亚铁—FeS2 B. 重晶石—BaSO4
C. 芒硝—Na2SO4·10H2O D. 绿矾—FeSO4·7H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com