
科目: 来源: 题型:
【题目】(1)氯酸钾和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O
①用单线桥表示上述反应中电子转移的方向和数目_____________________;
②浓盐酸在该反应中表现的性质是______(填序号);
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③该反应的还原产物是______________(填化学式);
④上述反应产生0.1 mol Cl2时,转移电子的物质的量为______________。
(2)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①在该反应中,氧化剂与还原剂的物质的量之比是_________________;
②KMnO4的氧化性比Cl2的氧化性______________;
③若在反应中生成了标况下2.24L氯气,则电子转移的个数是______NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于甘氨酸(H2N-CH2-COOH)性质的说法中正确的是
A. 只有酸性,没有碱性B. 只有碱性,没有酸性
C. 既有酸性,又有碱性D. 既没有酸性,又没有碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验误差分析错误的是( )
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验现象的描述中不正确的是( )
选项 | 实验 | 现象 |
A | 加热放在坩埚中的一小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热铝箔 | 铝箔熔化时失去光泽,熔化的铝并不滴落好像有一层膜包着 |
C | 点燃的镁条伸入盛有O2的集气瓶(底部铺有少量细沙)中 | 镁条继续燃烧,发出耀眼的白光,放出大量的热,生成白色固体 |
D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,放出大量的热 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确表达下列反应的离子方程式为
A. 用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=![]() +
+![]() + H2O
+ H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】由2—溴丙烷(CH3CHBrCH3)制备少量的1,2 — 丙二醇(HOCH2CHOHCH3)时需经过下列哪几步反应 ( )
A.加成、消去、取代B.消去、加成、取代
C.取代、消去、加成D.消去、加成、消去
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0.达到平衡后,以下分析正确的是
2NH3(g) △H<0.达到平衡后,以下分析正确的是
A. 增大压强,对正反应的反应速率影响更大
B. 升高温度,对正反应的反应速率影响更大
C. 减小反应物浓度,对逆反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
查看答案和解析>>
科目: 来源: 题型:
【题目】以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质 )为原料回收MnO2的工艺流程如下:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II.将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV. 向III所得溶液(pH约为6)中缓慢滴加0.50 molL-1 Na2CO3溶液,过滤,得滤渣b,其主要成分为MnCO3;
V. 滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι中Ag与足量稀HNO3反应生成NO的化学方程式为____________________。
(2)已知II的灼烧过程中同时发生反应:
MnO2(s)+C(s) = MnO(s) + CO (g) △H=+24.4 kJ mol -1
MnO2(s)+CO(g) = MnO(s)+CO2(g) △H=-148.1 kJ mol -1
写出MnO2和C反应生成MnO和CO2的热化学方程式:________。
(3)H2O2分子中含有的化学键类型为________、________。
(4)III中MnO2溶解的离子方程式为________,溶解一定量的MnO2,H2O2的实际消耗量比理论值高,用化学方程式解释原因:______________________________________。
(5)IV中,若改为“向0.50 molL-1 Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中会混有较多Mn(OH)2沉淀,解释其原因:________________________________________。
(6)V中MnCO3在空气中灼烧的化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有H+,Na+,Ba2+,Mg2+,Fe3+,Al3+,SO42﹣,CO32﹣等离子,当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列判断正确的是( )
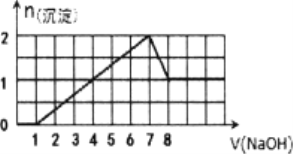
A. 原溶液中一定含有H+、Fe3+、Al3+,可能含Ba2+
B. 原溶液中含Fe3+和Al3+,物质的量之比为l:l
C. 原溶液中可能含有CO32﹣
D. 反应最后形成的溶液中含有的溶质只有NaAlO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com