
科目: 来源: 题型:
【题目】已知:还原性HSO3—>I—,氧化性IO3—>I2。在含3molNaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如下图所示。下列说法不正确的是
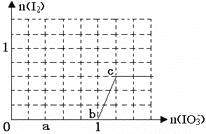
A. 0~a间发生反应:3HSO3—+IO3—=3SO42-+I—+3H+
B. a~b间共消耗NaHSO3的物质的量为1.8mol
C. b~c间反应:I2仅是氧化产物
D. 当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于铁矿石的说法正确的是
A.赤铁矿的主要成分是Fe3O4
B.铁矿石的主要成分与铁锈的主要成分相同
C.磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变红色
D.Fe3O4俗称铁红
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为______。
(2)下列关于CH4和CO2的说法正确的是______(填序号)。
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为____________,Ni该元素位于元素周期表的第___族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有_____molσ键。
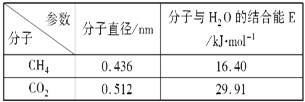
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。
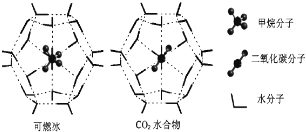
①“可燃冰”中分子间存在的2种作用力是______。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C内分别充入等质量的X、CO2、Y三种气体,当隔板静止时,A、C内的气体密度相等。下列说法不正确的是

A. 物质的量:n(X)<n(CO2)<n(Y)
B. 分子数目:N(X)=N(Y)
C. 气体的体积:V(X)=V(Y)
D. 摩尔质量:M(X)=M(Y)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如下转化关系,Z是NO,下列推断不合理的是:

A. X可能是一种氢化物
B. 若Y为单质,Y生成Z属于化合反应
C. E可能是一种有色气体
D. F中M元素的化合价可能为+5
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液可能含有 K+、NH4+、Ca2+、Cl–、SO42–、CO32–中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验:(所加试剂均过量,气体全部逸出)下列说法不正确的是

A. 原溶液中一定存在SO42–、CO32–和NH4+
B. 原溶液中一定不存在Ca2+,无法判断Cl–是否存在
C. 要确定Cl–是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D. 原溶液中 c(K+ )≥0.1 mol· Lˉ 1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于漂白粉的叙述不正确的是( )
A. 漂白粉的有效成分是Ca(ClO)2和CaCl2
B. 漂白粉在空气中久置后能变质
C. 漂白粉是由Cl2与石灰乳制得
D. 为了增强漂白粉的漂白效果,使用时可以加少量稀醋酸
查看答案和解析>>
科目: 来源: 题型:
【题目】I.1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。

(1)写出基态Cu原子的核外电子排布式____________________。
(2)写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)_________________。
II.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的外围电子排布式________。
(2)根据元素周期律,原子半径Ga_______As,第一电离能Ga______As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为_______,其中As的杂化轨道类型为________。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是__________________。
(5)GaAs的熔点为1 238 ℃,密度为ρ g·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以___________键键合。Ga和As的摩尔质量分别为M1 g·mol-1和M2 g·mol-1,原子半径分别为r1 pm和r2 pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为__________________________(列出含ρ和NA的计算式)。

查看答案和解析>>
科目: 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_____。
a.Ca2+ 与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是 _____________________(用离子方程式表示)。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_____,其中氧原子的杂化方式为____。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)═2ClF3(g)△H=﹣313kJmol﹣1,F﹣F键能159kJmol﹣1,Cl﹣Cl键的键能为242kJmol﹣1,则ClF3中Cl﹣F键的平均键能为________ kJmol﹣1,ClF3的熔、沸点比BrF3的_____(填“高”或“低”)。
(5)如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
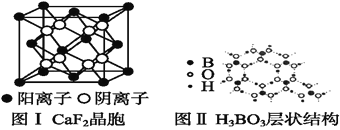
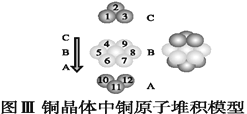
①图Ⅰ所示的CaF2晶胞中与Ca2+最近且等距离的F-数为____,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为____。
②图Ⅱ所示的物质结构中最外层已达8电子结构的原子是____。H3BO3晶体中B原子个数与极性键个数比为____。
③三种晶体中熔点最低的是____,其晶体受热熔化时,克服的微粒之间的相互作用力为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com