
科目: 来源: 题型:
【题目】下列属于氧化还原反应的是
A. 2NaHCO3![]() Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
C. 2KI+Br2=2KBr+I2 D. MgO+2HCl=MgCl2+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。N在元素周期表中的位置:____________。元素C、N最简单气态氢化物中稳定性更强的是_______(填化学式)。
氨气应用于侯德榜制碱工艺,原理如下图所示:

(1)过程i通入NH3和CO2的顺序是___________。
(2)过程ii有利于析出更多NH4Cl(s)的原因是_____________。
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)_________________。 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列变化中,不能说明SO2是酸性氧化物的是( )
A. 二氧化硫与水化合生成亚硫酸
B. 二氧化硫与氢氧化钠反应生成亚硫酸钠和水
C. 二氧化硫被催化氧化变为三氧化硫
D. 二氧化硫与氧化钙化合生成亚硫酸钙
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所表示的一些物质或概念间的从属关系不正确的是

X | Y | Z | |
A | 置换反应 | 氧化还原反应 | 离子反应 |
B | 冰水混合物 | 电解质 | 化合物 |
C | 淀粉溶液 | 胶体 | 分散系 |
D | 干冰 | 氧化物 | 纯净物 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】设 NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.2g 由氧气和臭氧组成的混合物中含有氧原子的数目为 0.3NA
B. 0.1 molL-1 的 FeCl3 溶液中 Cl-的数目为 0.3NA
C. 标准状况下,11.2L 水中含有原子的数目为 1.5NA
D. 1 mol Cl2 与足量的铁反应转移的电子数目是 2 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 能使pH试纸显蓝色的溶液中:Na+、ClO-、Fe3+、SO42-
B. 含有大量Al3+的溶液中:K+、Mg2+、NO3-、HCO3-
C. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
D. 常温下由水电离出的c(H+)=10-13 mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香烃X,相对分子质量为92。以X为初始原料合成E,路线如下(部分产物和反应条件已略去)。

回答下列问题:
(1)有机物X的结构简式为_________________。
(2)A→B的反应条件为________________________________。
(3)C→D转化中①的化学方程式为________________________________。
(4)下列关于B的说法正确的是____________。
a.核磁共振氢谱有5个峰 b.能发生消去反应和还原反应
c.能与钠反应放出氢气 d.能和NaOH溶液反应
(5)E有多种同分异构体,同时符合下列条件的同分异构体共有_______种。
①遇NaHCO3溶液有气体放出 ②芳香族化合物
其中不含甲基的有机物的结构简式为_________。
(6)有机物X可通过三步合成W,W是高分子化合物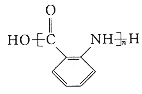 的单体。
的单体。
已知:Ⅰ.苯环上的甲基可以被酸性KMnO4氧化成羧基
Ⅱ.苯环侧链的硝基可被Fe/HCl还原为氨基,苯环侧链的氨基易被氧化
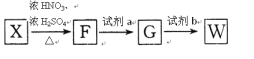
①F的结构简式为_______________,试剂a为_______________。
②在一定条件下W聚合成高分子化合物的化学方程式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。基态Ni原子的外围电子排布式为 ,该元素位于元素周期表中的第 族。
(2)碳元素能够形成不同的单质,如C60、C70、金刚石等等。
①C60、C70、金刚石这些单质间互称为 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。

③继C60后,科学家又合成了Si60、N60, C、Si、N三种原子电负性由大到小的顺序是 。
(3)铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
①Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为 。
②Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com