
科目: 来源: 题型:
【题目】M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A. M与R可以形成MR2型离子化合物
B. 在MR2中M的离子半径比R的离子半径大
C. 形成的两种离子分别是M+和R2-
D. MR2的电子式为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
A.容量瓶中原有少量的蒸馏水B.移液时,不慎将液体流到瓶外
C.溶解后没有冷却就转移到容量瓶中D.定容时仰视观察刻度线和液面
查看答案和解析>>
科目: 来源: 题型:
【题目】氯乙酸(ClCH2COOH)常用作制造各种染料、除锈剂等。实验室采用乙酸氯化法(Cl2和冰醋酸共热可制得氯乙酸,伴随有醋酸的多氯代物生成)合成氯乙酸的装置如下图(加热装置省略)。
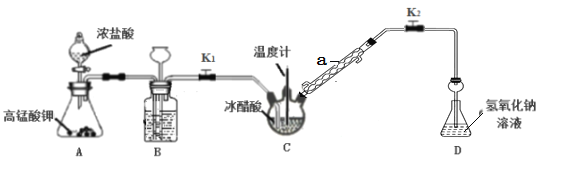
请回答下列问题:
(1)仪器a的名称为______________(填仪器名称)。
(2)装置A中发生反应的离子方程式为_________________________________________。
(3)仪器组装完成,关闭分液漏斗活塞和止水夹K2,打开K1,向装置B中长颈漏斗中注入液体至形成一段水柱,若__________________________,则气密性良好。
(4)装置B的作用之一是观察Cl2的生成速率,则B中盛放的液体为_____________。实验结束时,关闭分液漏斗活塞和止水夹K1,此时装置B的作用是_________________________。
(5)通过佛尔哈德法可以测定氯乙酸产品中氯元素的质量分数,实验步骤如下:
Ⅰ.取0.284g粗产品于锥形瓶中,加入足量NaOH溶液,煮沸,完全水解后加稀硝酸调至酸性。
Ⅱ.向锥形瓶中加入0.4200mol·L-1的AgNO3溶液10.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2.00mL硝基苯,用力摇动,使沉淀表面被硝基苯覆盖。
Ⅳ.加入指示剂,用0.0200mol·L-1NH4SCN标准溶液滴定过量Ag+至终点,消耗10.00mLNH4SCN溶液。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12。
①滴定选用的指示剂是_______ (填代号)。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是_____________________________,若无此操作所测氯元素的质量分数将会_______ (填“偏大”、“偏小”或“不变”)。
③粗产品中氯元素的质量分数为 _________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向盛有氯化铁溶液的烧杯中加入过量的铜粉,反应结束后,溶液中大量存在的金属离子是
A.Fe2+、Fe3+B.Fe2+、Cu2+
C.Fe3+、Cu2+D.Cu+、Cu2+
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤会产生CO2、CO、SO2等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
1/4CaSO4(s)+CO(g) ![]() 1/4CaS(s) + CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
1/4CaS(s) + CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
(1)计算反应CaO(s) + 3CO(g ) + SO2(g) ![]() CaS(s) +3 CO2(g) ΔH=____________。
CaS(s) +3 CO2(g) ΔH=____________。
(2)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应I,下列能说明该反应已达到平衡状态的是_____________(填序号)
a.容器内的压强不发生变化 b.υ正(CO)=υ正(CO2)
c.容器内气体的密度不发生变化 d.n(CO)+n(CO2)=1mol
(3)一定温度下,体积为1L容器中加入CaSO4(s)和1molCO,若只发生反应II,测得CO2的物质的量随时间变化如下图中曲线A所示。
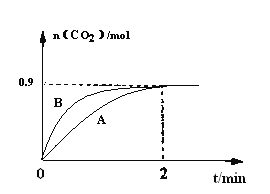
①在0~2min内的平均反应速率v(CO)=____________。
②曲线B表示过程与曲线A相比改变的反应条件可能为____________答出一条即可)。
③若要提高反应体系中CO2的体积分数,可采取的措施为__________________。
(4)一定温度下,向恒容密闭容器中加入CaSO4(s)和1molCO,下列能说明反应I和反应II同时发生的是________________(填代号)。
a.反应后气体能使品红褪色
b.反应过程中,CO的体积分数逐渐减小
c.反应体系达平衡前,SO2和CO2两种气体的浓度之比随时间发生变化
d.体系压强逐渐增大
(5)烟道气中的SO2和CO2均是酸性氧化物,也可用氢氧化钠溶液吸收。
已知:25℃时,碳酸和亚硫酸的电离平衡常数分别为:
碳酸 K1=4.3×10-7 K2=5.6×10-11
亚硫酸K1=1.5×10-2 K2=1.0×10-7
①下列事实中,不能比较碳酸与亚硫酸的酸性强弱的是__________(填标号)。
a.25℃下,饱和碳酸溶液pH大于饱和亚硫酸溶液pH
b.25℃下,等浓度的NaHCO3溶液pH大于NaHSO3溶液
c.将SO2气体通入NaHCO3溶液,逸出气体通入澄清石灰水,澄清石灰水变浑浊
d.将CO2气体通入NaHSO3溶液,逸出气体通入品红溶液,品红溶液不褪色
②25℃时,氢氧化钠溶液吸收烟道气,得到pH=6的吸收液,该溶液中c(SO32-):c(HSO3-)=___________。
③H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作中,不正确的是( )
A.用托盘天平称取 4.5 g 固体氯化钠B.在烧杯中稀释浓硫酸
C.用温度计代替玻璃棒搅拌溶液D.在蒸发皿中蒸发浓缩食盐水
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中有关试剂的保存方法错误的是 ( )
A. 少量金属钠保存在煤油当中 B. 少量白磷保存在水中
C. 烧碱溶液保存在带玻璃塞的试剂瓶中 D. 氢氟酸保存在塑料瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】在同温同压下,将10mL某气态烃,在60mLO2里充分燃烧,得到液态水和体积为45mL的混合气体,则该烃可能为( )
A.甲烷B.乙烷C.丙烷D.乙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】空气中的氧分子在阳光紫外线、闪电等外界因素作用下,会生成氧负离子(O2 - )。O2 -的摩尔质量为( )
A.33 gB.33 g· mol-1C.32 gD.32 g· mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com