
科目: 来源: 题型:
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述不正确的是
A.H2Y的电离方程式:H2Y![]() 2H+ + Y2-
2H+ + Y2-
B.HY- 水解的离子方程式:HY- + H2O![]() H2Y + OH-
H2Y + OH-
C.该酸式盐溶液中离子浓度大小关系:c(Na+) > c(HY-)>c(OH-) >c(H+)
D.该酸式盐溶液中微粒浓度关系:c(H+)+c(H2Y) = c(OH-)+c(Y2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子。若向其中加入过氧化钠粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是
A.CO32-、NO3- B.NO3-
C.SO32-、NO3- D.CO32-、NO3-、Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是
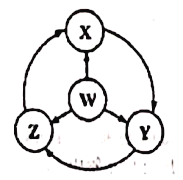
选项 | W | X | Y | Z |
A | Fe | Fe(OH)2 | FeCl3 | FeCl2 |
B | Na | Na202 | NaOH | NaCl |
C | S | SO2 | SO3 | H2SO4 |
D | A1 | AlCl3 | NaAlO2 | Al2(SO4)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知一定质量的锌粒与1.0L稀盐酸反应(放热反应),生成H2的物质的量与反应时间的关系如图所示,下列结论不正确的是
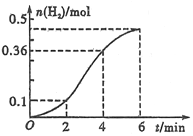
A. 若将锌粒改为锌粉,.可以加快产生H2的反应速率
B. 反应前4 min内温度对反应速率的影响比浓度大
C. 反应前4 min内平均速率v(HC1)=0.18 mol·L-1·min-1
D. 向该反应中加入大量的CuSO4固体,会使生成氢气的速率加快
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验过程中没有沉淀出现的是
A. 向常温时的饱和碳酸钠溶液中通入足量CO2气体 B. 向硅酸钠溶液中通入氯化氢气体
C. 向氯化钙溶液中通入SO2气体 D. 向次氯酸钙溶液中通入CO2气体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化合物:①Na2O2、②Fe(OH)3、③FeCl2、④CuS、⑤H2SiO3、⑥NaHCO3,其中不能通过化合反应制得的有几项?
A. 一项 B. 二项 C. 三项 D. 四项
查看答案和解析>>
科目: 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。
请回答:
(1)已知:2Al2O3(s)===4Al(g)+3O2(g) ΔH1=3 351 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH2=-221 kJ·mol-1
2Al(g)+N2(g)===2AlN(s) ΔH3=-318 kJ·mol-1
碳热还原Al2O3合成AlN的总热化学方程式是________________________,
该反应自发进行的条件________。
(2)在常压、Ru/TiO2催化下,CO2和H2混合气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH4
CH4(g)+2H2O(g) ΔH4
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5
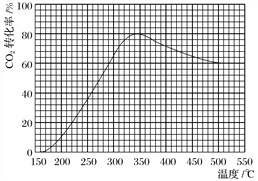
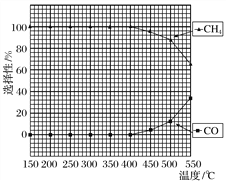
图1 图2
①下列说法不正确的是________。
A.ΔH4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
②350 ℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数为________(用a、V表示)。
③350 ℃下CH4物质的量随时间的变化曲线如图3所示。画出400 ℃下0~t1时刻CH4物质的量随时间的变化曲线。__________________________
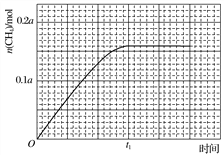
图3
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图装置也可用于检验溴乙烷与氢氧化钠的醇溶液反应生成物乙烯的检验,下列说法不正确的是
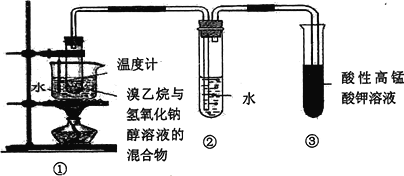
A. 该反应为消去反应 B. 反应实验过程中可观察到酸性KMnO4溶液褪色
C. 可用溴水溶液代替酸性KMnO4溶液 D. 乙烯难溶于水,故此装置②可以省去
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是 ( )。
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B.浓硫酸与单质硫反应的化学方程式为:S+2H2SO4(浓) ![]() 3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
C.把足量铜粉投入到只含H2SO4 2 mol的浓硫酸中,得到气体体积标准状况下为22.4 L
D.常温下能够用铁、铝等容器盛放浓H2SO4,是因为浓H2SO4的强氧化性使其钝化
查看答案和解析>>
科目: 来源: 题型:
【题目】A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.06g·L-1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。

请回答:
(1)有机物D中含有的官能团名称是__________________。
(2) D+E→F的反应类型是_________________________。
(3)有机物A在高温下转化为B的化学方程式是_________________。
(4)下列说法正确的是___。
A.有机物E与金属钠反应比水与金属钠反应要剧烈
B.有机物D、E、F可用饱和Na2CO3溶液鉴别
C.实验室制备F时,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com