
科目: 来源: 题型:
【题目】下列有关钠的化合物说法正确的是( )
A. 将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
B. 用加热法除去NaHCO3固体中混有的Na2CO3
C. 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,一定没有K+
D. Na2O2可用于呼吸面具中氧气的来源
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表述正确的是
A. 二氧化硅是将太阳能转化变为电能的常用材料
B. 玻璃、水晶、玛瑙的主要成分都是硅酸盐
C. 水玻璃可用于生产黏合剂和防火剂
D. 二氧化硅既能跟HF反应,又能跟NaOH反应,因此二氧化硅是两性氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔(C2H2)是制造草酸、乙醛、醋酸等有机化合物的基本原料。
(1)某小组同学以电石(主要成分为CaC2,含少量CaS及Ca3P2等杂质)为原料,利用下图所示实验装置(夹持装置略去,下同)制备C2H2。

①仪器a的名称为__________________________。
②CaC2的电子式为________________________________。
③装置B中的NaClO溶液能将H2S、PH3氧化为硫酸、磷酸,本身被还原为NaCl。其中PH3被氧化的离子方程式为________________________________。
(2)该小组同学通过查阅文献资料得知:用Hg(NO3)2作催化剂时,浓硝酸能将乙炔气体氧化为草酸(H2C2O4),实验装置如下图所示。

①装置E的作用是_________________________________________。
②装置D中生成H2C2O4的化学方程式为_________________________________。
③装置D中锥形瓶内的液体经过___________(填操作名称)、洗涤、干燥等步骤得到H2C2O4·2H2O晶体。
(3)该小组同学测定了晶体中H2C2O4·2H2O的质量分数,实验步骤如下:
i.准确称取mg晶体,加入适量的蒸馏水溶解,再加入少量稀硫酸;
ii.将i所得溶液用c mol/LKMnO4标准溶液进行滴定,滴定时KMnO4被还原为Mn2+,滴定至终点时消耗标准溶液VmL。
①滴定过程中发现褪色速率先慢后明显加快,除反应放热外,还可能的原因是____________。
②晶体中H2C2O4·2H2O的质量分数为_________(用含m、c、V的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸亚铬晶体是一种氧气吸收剂,化学式为[Cr(CH3COO)2]22H2O,不溶于冷水,易溶于盐酸.由于Cr2+易被氧气氧化,制备醋酸亚铬时,需在封闭体系中用锌作还原剂,先将Cr3+还原为Cr2+,再与醋酸钠溶液作用制得,其总反应为:2Cr3++Zn+4CH3COO﹣+2H2O═[Cr(CH3COO)2]22H2O+Zn2+。请回答下列问题:

(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是_______________________.
(2)实验开始前,必需进行的实验操作是________;实验开始时,打开恒压滴液漏斗的旋塞,让盐酸滴入装置2中,打开A,关闭B,目的是___________________________,反应一段时间后,保持盐酸持续滴下,关闭A,打开B,目的是__________________________________.
(3)已知其它反应物足量,实验时取用的是含溶质3.17g CrCl3溶液和1L 0.1molL﹣1的醋酸钠溶液;实验后得干燥纯净的醋酸亚铬晶体2.82g,则该实验所得产品的产率为_____%(不考虑醋酸亚铬晶体的溶解损失).
(4)为标定实验所用的CrCl3溶液,进行了如下操作:
取25.00mLCrCl3溶液于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入适量Na2O2,充分加热煮沸,稀释,加入过量的稀H2SO4至溶液呈强酸性,此时铬以Cr2O72﹣存在;再加入足量KI,密塞,摇匀,于暗处静置5分钟后,用0.25molL﹣1硫代硫酸钠溶液滴定至溶液呈淡黄色,加入l mL指示剂,滴定至终点.平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL.
已知:Cr2O72﹣+6I﹣+14H+═2Cr3++3I2+7H2O,2S2O32﹣+I2═S4O62﹣十2I﹣.
①实验所用的CrCl3溶液的物质的量浓度为_______.
②滴定过程中所用的指示剂是________.
③下列操作导致实验结果偏低的是___________.
a.移取CrCl3溶液的滴定管,水洗后未用CrCl3溶液润洗
b.盛硫代硫酸钠溶液的滴定管滴定前有气泡,滴定后无气泡
c.量取CrCl3溶液时先俯视后仰视
d.滴定终点时,盛硫代硫酸钠溶液的滴定管尖嘴外挂有一滴液珠未滴落.
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2;控制pH是为了使Al3+转化为A1(OH)3进入固体2
C. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
D. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
查看答案和解析>>
科目: 来源: 题型:
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质

(1)Ti是一种活泼金属,原子核内有22个质子,它在周期表中的位置是____________。
(2)根据上表信息推测TiCl4中含有的化学键类型是_______________。
(3)MgCl2的电子式为____________。
(4)氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_________________。
(5)精制过程:粗TiCl4经两步蒸馏得纯TiCl4如图。

①物质a是__________________(填化学式)。
②T1应控制在______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行)。
![]()
(1)若B的溶液显黄色,一定条件下B的饱和溶液可与沸水反应生成红褐色分散系
①实验室制A单质的反应的离子方程式_______________________________________;
A单质的常用检验方法____________________________
②C溶液中加入氢氧化钠溶液的现象_________________________________________;
③一定条件下W与水反应的化学方程式_______________________________________;
(2)若W为NaOH,且B为白色沉淀
①C的化学名称为______________;
②W与某金属单质也可生成C,该反应的离子方程式______________________________;
③B与W反应生成C的离子反应方程式________________________________________;
(3)若B能使品红褪色,加热又变红,C能与水反应生成一种强酸
①B转化为C的化学方程式_________________________________________________
②若A是一种化合物,A与B反应的化学方程式__________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于甲、乙、丙、丁四种有机物说法正确的是( )

A. 甲、乙、丙、丁中加入NaOH的醇溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成
B. 甲中加入NaOH的水溶液共热,再滴入AgNO3溶液,可检验该物质中含有的卤素原子
C. 乙发生消去反应得到两种烯烃
D. 丙与NaOH的水溶液共热,反应后生成的醇能被氧化为醛
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
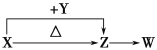
请回答:
(1)W的化学式是________
(2)X与Y在溶液中反应的离子方程式是_________________________________
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中产生白色沉淀,装置V中可收集到一种无色气体。

①装置II反应化学方程式是______________,1mol固体参加反应,转移电子数目_____
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是________,所需仪器装置是_____________
(从上图选择必要装置,按照气流顺序填写编号)
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com