
科目: 来源: 题型:
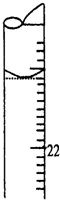 某学生用0.1000mol?L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol?L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:查看答案和解析>>
科目: 来源: 题型:
 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目: 来源: 题型:
 (1)未用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑.则铁锅的锈蚀属于
(1)未用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑.则铁锅的锈蚀属于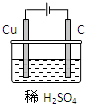

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 Al(OH)3+3H+;
Al(OH)3+3H+; Al(OH)3+3H+;
Al(OH)3+3H+;查看答案和解析>>
科目: 来源: 题型:
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com