
科目: 来源: 题型:
【题目】下列有关说法不正确的是
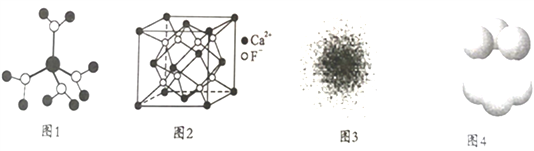
A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. 氢原子的电子云图如图3所示,氢原子核外的大多数电子在原子核附近运动
D. 金属Cu中铜原子堆积模型如图4所示,该金属晶体为最密堆积,每个铜原子的配位数均为12
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置进行下列实验,现象和结论均正确的是
选项 | ① | ② | ③中现象 | 结论 | 装置图 |
A | 浓硝酸 | Cu | 淀粉-KI溶液变蓝 | NO2为氧化性气体 |
|
B | 稀硫酸 | Na2SO3 | 品红溶液褪色 | Na2SO3未变质 | |
C | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
D | 浓氨水 | NaOH | 湿润红色石蕊试纸变蓝 | NH3为碱性气体 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z、R的原子序数依次增大,A、B、C、D、E、F均是由上述元素组成的中学化学常见物质,其中A是四元化合物,C是能使湿润红色石蕊试纸变蓝的气体,D具有漂白性,E是单质。各物质之间存在如图转化关系(部分产物未标出)。下列说法不正确的是( )

A. 简单离子半径大小关系:Y>Z>RB. 简单阴离子的还原性:W>Y>Z
C. 氢化物的沸点:Z>Y>XD. C和E反应生成F是工业制硝酸的重要反应之一
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于镁和钠的比较结论正确的是( )
A.都是银白色的金属,在空气中都能稳定存在
B.钠的金属活动性比镁强,所以钠的熔点比镁高
C.都能与稀硫酸发生置换反应,有气体放出
D.在空气中都能燃烧,生成的产物都是氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G是元素周期表前四周期中常见的七种元素,其原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | A的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
B | B原子基态时s电子与p电子数目相同 |
C | C在组成化合物时没有正价 |
D | 常温常压下,D单质是淡黄色固体,常在火山口附近沉积 |
E | E和D同周期,E的电负性大于D |
F | F原子基态时未成对电子数是同周期中最多的 |
G | G的一种核素的质量数为63,中子数为34 |
(1)AB32-的立体构型为________,其中A的杂化轨道类型是_________________________;
(2)A22-与B22+互为等电子体,则B22+的电子式可表示为______________,1molB22+中含有共用电子对的数目为_____________;
(3)AD2是一种常用的溶剂,AD2的分子中存在___个π键。表中C、D、E三种元素分别与氢形成的共价键中,键长最大的是________(用具体元素符号组成的化学键表示)。
(4)下列有关A2H2的说法正确的是_____。
A.分子中所有原子都满足8电子稳定结构 B.每个分子中σ键和π键数目之比为2:3
C.它是由极性键和非极性键构成的分子 D.分子的空间构型为直线形
(5)写出G元素的原子核外电子排布式___________;工业上常通过在空气中煅烧G的低价含硫矿获得G单质,请写出该反应的方程式_____________________________;若往含有G2+的溶液中加过量氢氧化钠溶液,可生成Na2[G(OH)4]溶液,Na2[G(OH)4]具有的化学键类型有________。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键
(6)表中F元素与Mn、Fe在工业上统称“黑色金属”,Mn、Fe 均为第 4 周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/kJmol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 4048 | 2957 | |
F元素为_____(填写元素名称);请写出基态 Mn2+的价电子轨道排布图____________________,比较两元素的 I2、 I3可知,气态 Mn2+再失去 1个电子比气态 Fe2+再失去 1个电子难,请解释原因__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 硫酸和氢氧化钡溶液混合:H++OH-=H2O
B. 铜与浓硫酸: Cu + 2H+ =Cu2+ + H2↑
C. 银片插入硝酸铜溶液中:Cu2++2Ag = Cu+2Ag+
D. 大理石与稀盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的单质及一些化合物在工农业生产等领域有重要作用,回答下列问题
(1)N原子核外有________不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道形状为_____________________;
(2)N与同一周期中左右相邻的两种元素原子的第一电离能大小关系为______________(填元素名称),该电离能大小变化的原因为______________________________________________;
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为____________________;与NO2+互为等电子体的微粒有_______________(写出一种)。
(4)含氮的某些配体可与Co3+配位,请判断Co元素位于元素周期表中的____________区(填s、p、d、ds或f),试写出该Co元素基态原子的核外电子排布式________________________;Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数为_______________。已知配体N3-与CO2为等电子体,判断N3-的空间立体构型为_____________________。
(5)已知N的电负性大于Cl,NCl3能与水发生剧烈的水解反应,反应得到两种高中常见的化学物质,则发生的化学方程式为_______________________________________________。
(6)由H、C、N、O四种元素共同组成的四原子分子具有多种不同的结构,请写出其中两种满足稳定结构的链状异构体的电子式____________________、______________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用下列装置制备无水AlCl3(183℃升华,過潮湿空气即产生大量白雾)。下列说法正确的是

A. 该实验过程中e瓶可能产生白雾
B. b、c装置中分别盛装饱和NaHCO3溶液和浓硫酸
C. 实验开始时应先点燃d处酒精灯,再点燃a处酒精灯
D. 实验后向烧瓶中加入足量硝酸银和确硝酸,可确定生成的MnCl2的质量
查看答案和解析>>
科目: 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )
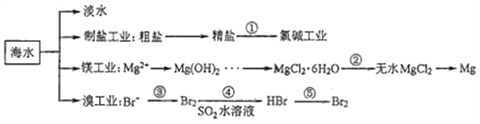
A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去)。
![]()
(1)A、B、C、W均为气体,若A是无色有刺激性气味的气体, 气体B遇到空气变成红棕色。
①写出气体C溶于水的化学方程式______________;
②检验气体A的操作方法是______________;
(2)若A是一种黄绿色的气体,W是一种常见的金属单质。
①实验室制取气体A的离子方程式________________;
②B与W转化为C的离子反应方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com