
科目: 来源: 题型:
【题目】298K、1.01×105Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式正确的是

A. Se(s)+ H2(g) = H2Se(g) ΔH=-242kJ·mol-1
B. Se(s)+ H2(g) = H2Se(g) ΔH=-20kJ·mol-1
C. Se(g)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1
D. Se(s)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1mol CO和2 molH2,向乙中加入2 molCO和4molH2, 测得不同温度下CO的平衡转化率如图2所示。下列说法正确的是
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1mol CO和2 molH2,向乙中加入2 molCO和4molH2, 测得不同温度下CO的平衡转化率如图2所示。下列说法正确的是
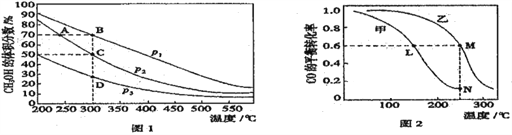
A. 该反应的ΔH> 0; P1> P2 B. 反应速率B点高于D点
C. A、C两点的平衡常数相同 D. M、L两点中,CH3OH的体积分数相同,且p(M)= 2p(L)
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组为了探究木炭与浓硝酸反应后的气态生成物,设计如下实验。
(1)甲同学设计实验如图甲。
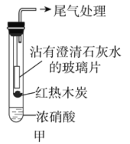
红热木炭未进入试管前,浓硝酸上方并无明显变化。当如图甲连接实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片出现浑浊,后浑浊消失。
①液面上方出现红棕色气体,说明浓硝酸具有________(填选项字母)。
a.酸性 b.挥发性 c.不稳定性
②沾有澄清石灰水的玻璃片出现浑浊,________(填“能”或“不能”)说明木炭与浓硝酸发生了反应,是因为________。
(2)乙同学设计实验如图乙。
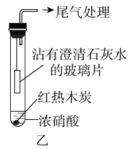
如图乙连接实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片无明显变化。沾有澄清石灰水的玻璃片无明显变化,________(填“能”或“不能”)说明木炭与浓硝酸未反应,是因为________。
(3)丙同学克服了甲、乙同学设计上的缺点,设计实验如图丙。已知酸性高锰酸钾能将NO、NO2 氧化成 NO3-,MnO4- 被还原为 Mn2+。
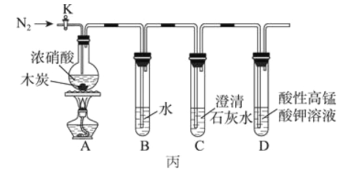
①如图连接装置后,需进行的实验操作为________;加热木炭与浓硝酸前需先通一段时间N2,目的为________________。
②装置A中木炭与浓硝酸反应的化学方程式为_________________________。
③能证明木炭被氧化的实验现象为________________________________________。
④D 装置中发生反应的离子方程式为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与社会、生产、生活密切相关。下列说法不正确的是( )
A. Na2O2能与CO2反应,可用作呼吸面具的供氧剂
B. 二氧化碳气体能造成温室效应
C. 漂白粉中的有效成分是次氯酸钙
D. 晶体硅是制取光导纤维的主要材料。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的分类有多种方法,下列对无机化合物分类如图:

(1)如图所示的物质分类方法的名称是________。
(2)以元素 Na、Ba、H、O、S、N 中任意两种或三种元素组成合适的物质,将化学式分别填在下表中④、⑥的后面________、__________

(3)⑦和⑧的水溶液可导电,它们________(填“是”或“不是”)电解质;相同质量的两气体所含氧原子的个数比为________;标准状况下等体积两气体的质量比为________。
(4)少量⑧与足量④的溶液反应的离子方程式为________。
(5)写出⑦与⑨反应的化学方程式________。
(6)写出工业制造硝酸过程中⑩NH3 与氧气反应的化学方程式为________,若 16g 氧气全部被还原,则转移电子________mol。
(7)现有由①与②混合的稀溶液 100mL,其中①的物质的量浓度为 2.0mol·L-1,②的物质的量浓度为 1.0mol·L-1。则该溶液能溶解铜的最大质量为________g,同时,反应生成的气体在标准状况下的体积为________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. 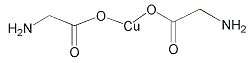 σ键和π键比例为7:1
σ键和π键比例为7:1
C. C![]() 与O
与O![]() 互为等电子体,1 mol O
互为等电子体,1 mol O![]() 中含有的π键数目为2NA
中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图所示各装置和实验室制取氧气的原理,回答下列问题:

(1) 仪器B的名称为______________。
(2) 用mgMnO2和n g KC1O3组成的固体混合物加热制取氧气时,可选用的实验装置是_____(填装罝序号)。
(3) 将MnO2和KC1O3的混合物充分加热至不再产生氧气时,若要将其中的催化剂MnO2回收再利用,应进行的实验操作是将固体冷却、加水溶解、______、洗涤、干燥。证明MnO2固体已洗涤干净的操作方法为____________________。
(4) 将(2)中的固体混合物加热一段时间,冷却后称得剩余固体为p g,则当(m+n-p):n=___时,表明KC1O3已完全分解。
(5) 用双氧水和MnO2制取氧气时,不能选用装置c,其原因是________________。
(6) 用装置d制取氨气时,所需的化学药品是__________________________。用电子式表示氨气的形成过程__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F是短周期主族元素,且原子序数依次增大。在短周期中A元素原子半径最小,D元素原子半径最大,B的简单氢化物的水溶液呈碱性,C、E同主族,形成的化合物为EC2、EC3。回答下列问题:
(1)E在元素周期表中的位置为__________。
(2)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与Na2O2的结构和化学性质相似,其溶液显黄色。H的电子式为______。
(3)化学家发现一种化学式为A4B4的化合物,由均带一个电荷的阴、阳离子组成,则该阴、阳离子为_______。
(4)B2A4C3是一种常见的炸药,其在常温下撞击时会生成一种气体(B2C)和一种常见液体,该反应的化学力程式为______________。8g该物质反应转移的电子数目为________。
(5)下列事实能说明元素F的非金属性比元素E的非金属性强的是______。
a.元素F形成的单质比元素E形成的单质的熔点低
b.F和E两元素的简单氢化物受热分解,前者的分解温度高
c.F2通入到D2E的溶液中出现浑浊
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。
(1) HWO的结构式为____。
(2) ①X、Y、Z、W原子半径由大到小依次是____(填元素符号)。
②X、Z、W最高价氧化物水化物酸性由强到弱依次是_________。(填化学式)。
(3) W同族上一周期元素单质不能把W元素从其钠盐的水溶液中置换出来,用化学方程式解释____________________。
(4) ①家用“管道通”的有效成分是烧碱和Y的单质,使用时需加入一定量的水,此时发生反应的化学方程式为_________________________。
②含Y元素的盐与小苏打溶液可用作泡沫灭火剂,写出灭火时发生反应的离子方程式__________________________________。
(5) NW3是黄色油状液体,无漂白性,在热水中会发生水解。NW3的电子式为____。若取该液体滴入50℃左右的热水中,片刻后取该热水溶液滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色。写出NW3在热水中发生水解的化学方程式__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某氯化镁溶液的密度为 1.16g·cm-3,其中镁离子的质量分数为 4.1%,500mL 该溶液中 Cl-的物质的量浓度约等于( )
A. 4.0mol·L-1B. 2.4mol·L-1C. 2.1mol·L-1D. 1.26mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com