
科目: 来源: 题型:
【题目】两种有机化合物甲、乙的球棍模型如图所示,下列说法错误的是
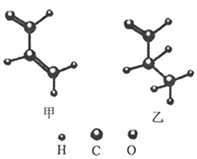
A. 甲、乙互为同系物,都能使酸性高锰酸钾溶液褪色
B. 甲分子中所有原子可能处于同一平面内
C. 用红外光谱能区分甲、乙两种物质
D. 一定条件下,甲与足量H2反应后,可得到1-丙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设: 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验: 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN试剂。
(1)若假设1成立,则实验现象是_______________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?__________简述你的理由(不需写出反应的方程式)____________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是__________,写出发生反应的离子方程式______、__________、______________。
探究延伸:
(4)如果经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。某实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】阿克拉酮是合成某种抗癌药的重要中间体,其结构如图所示。下列关于阿克拉酮的性质的描述,不正确的是

A. 阿克拉酮的分子式为C22H22O8
B. 分子中含有3个手性碳原子
C. 该分子一定条件下能发生取代、氧化、消去反应
D. 1 mol该物质最多可与3 mol NaOH反应
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A的键线式结构为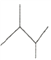 ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法正确的是
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法正确的是
A. 有机物A的一氯取代物有3种
B. 有机物A的名称为2,3—二甲基戊烷
C. 有机物B与CH≡C-(CH2)3—CH3互为同分异构体
D. B的结构可能有2种,其中一种化学名称为2,3-二甲基-2-丁烯
查看答案和解析>>
科目: 来源: 题型:
【题目】化学知识在生活中有重要意义,下列说法不正确的是( )
A. 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮氧化变质
B. 烧碱可以用于治疗胃酸过多
C. 计算机芯片所用的材料是高纯度的硅
D. 纯净的二氧化硅是生产光纤制品的基本原料
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下列装置或操作说法错误的是

A. 图1中:将胶头滴管中的水滴入到金属钠中,能看到U形管右侧红墨水高度不变
B. 图2中:观察到湿润的有色布条能褪色,待尾气全部被碱吸收后,将稀硫酸滴入烧杯中,至溶液显酸性,可能看到有黄绿色气体生成
C. 图3可用于制备、收集乙酸乙酯
D. 图4可以比较KMnO4、Cl2和S氧化性的相对强弱
查看答案和解析>>
科目: 来源: 题型:
【题目】某含C、H、O三种元素的未知物M的相对分子质量小于100,经燃烧分析实验测定该未知物碳的质量分数为40%,氢的质量分数为6.7%。由此所得结论正确的是
A. M的分子式为CH2O B. M的实验式为CH30
C. M不可能是2-羟基丙酸 D. M可能是饱和一元羧酸
查看答案和解析>>
科目: 来源: 题型:
【题目】(6分)将4molSO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2(g)+O2(g)![]() 2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时SO3的浓度;
(2)该温度下的平衡常数;
(3)平衡时SO2的转化率。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室拟用如下装置进行SO2的制备及性质实验
①已知稀硝酸、亚硝酸作为氧化剂时,一般其还原产物为一氧化氮。
②lg2=0.3
③SO2易溶于水,通常条件下溶解的体积比为1∶40

回答下列问题:
(1)①制取SO2反应的化学方程式为_____________________________________________。
②实验开始时加入的5g CaCO3的作用是_____________________________________。
(2)①当__________________时,将NaHSO3晶体抖入烧瓶中,观察到D瓶及E瓶出现大量沉淀,
②写出D瓶中发生反应的离子方程式_____________________________________。
③(1)、(2)两步反应A中的导气管口的位置是_____________。
A.前“a”后“b” B.前“a”后“a” C.前“b”后“b” D.前“b”后“a”
(3)实验结果,B中仍澄清透明,C中稍有浑浊,通过手持技术检测B、C溶液中pH变化得到如下图象:

通过理论计算,若C中所有的NO3-被还原,所得溶液冲稀10倍后pH为_______(精确小数点后一位)
(4)结果分析,与实验方案评价SO2通入BaCl2溶液中与通入Ba(NO3)2溶液中pH 相差不大,若估测NO3-能将SO2氧化,理论计算值与实际测得值相差很大,分析其原因是同条件下:稀HNO3的氧化性_____ 稀 HNO2的氧化性(填“强于”或“弱于”或“接近”)。该实验设计在安全方面存在缺陷,请在不增加试剂瓶的前提下加以改进_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com