
科目: 来源: 题型:
【题目】用下列方法制取氢气,反应速率最大的是
A.冬天,块状锌与2 mol·L一1硫酸溶液反应
B.冬天,粉末状锌与2 mol·L一1硫酸溶液反应
C.夏天,块状锌与2 mol·L一1硫酸溶液反应
D.夏天,粉末状锌与2mol·L一1硫酸溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】根据金属活动性顺序表,Cu不能发生:Cu+2H2O=Cu(OH)2↓+H2↑的反应。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,能实现该反应最为恰当的是
A | B | C | D | |
阳极 | 石墨棒 | Cu | Cu | Cu |
阴极 | 石墨棒 | 石墨棒 | Fe | Pt |
电解液 | CuSO4溶液 | Na2SO4溶液 | H2SO4溶液 | H2O |
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求答题:
(1)海水是一个巨大的资源宝库,海水开发利用制取Cl2的离子方程式:____________。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:____________。
(3)除去Na2CO3粉末中混入的NaHCO3杂质最佳方法是_________,化学方程式为___________。
(4)除去CO2气体中混入的HCl气体杂质,需将气体通入_________中,其离子方程式为______。
(5)生活中通常用二氧化碳做灭火剂,但镁条着火不能用二氧化碳灭火,其相关原因的化学方程式是: ____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】煅烧铵明矾晶体时发生的主要反应为:4[NH4Al(SO4)2·12H2O] ![]() 2Al2O3+N2↑+2NH3↑+3SO2↑+53H2O+5SO3↑,将产生的气体通过如图所示的装置(广口瓶中的试剂均足量)。
2Al2O3+N2↑+2NH3↑+3SO2↑+53H2O+5SO3↑,将产生的气体通过如图所示的装置(广口瓶中的试剂均足量)。
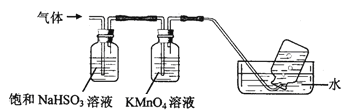
(1)集气瓶中最终收集到的气体是______ (填化学式,下同)。
(2)通过足量饱和NaHSO3溶液后大量减少的气体有______ 。
(3)KMnO4溶液颜色逐渐褪去,发生反应的离子方程式为______ 。
(4)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,反应后溶液中溶质的成分不可能是______ (填字母)。
A.(NH4)2SO4、Al2(SO4)3 B.(NH4)2SO4
C.(NH4)2SO4、Ba(AlO2)2 D.(NH4)2SO4、Al2(SO4)3、Ba(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾是一种新型绿色氧化剂,制备高铁酸钾的工艺流程如下:

回答下列问题:
(1)步骤①中NaClO作______(填“氧化剂”“还原剂”或“催化剂”)。
(2)步骤②脱除的盐是______(填他学式)。
(3)步骤③是利用溶解度的不同进行的操作。则溶解度:Na2FeO4_____(填“>”或“<”)K2FeO4。
(4)本次实验中K2FeO4的产率为______。
(5)取少量K2FeO4于试管中,加硝酸酸化并堵住试管口,观察到溶液中有细微的小气泡产生,溶液紫色逐渐褪去,伸人一根带火星的木条,木条复燃;再向溶液中加入KSCN溶液,溶液变为血红色。则K2FeO4酸化时发生反应的离子方程式为_________;K2FeO4作为净水剂的优点除铁无毒外还有________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:

(1)ClO2发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为__________________(用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________________________。
(3)吸收器中生成NaClO2的离子反应方程式为________________________________。
(4)某化学兴趣小组用如下图所示装置制备SO2并探究SO2与Na2O2的反应:
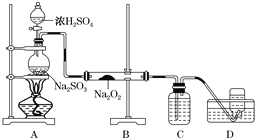
①盛放浓H2SO4仪器名称为____________。
②D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为__________________、Na2O2+SO2===Na2SO4。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图4所示:
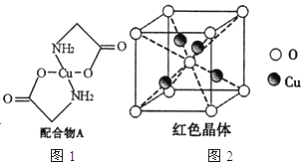
(1)Cu元素基态原子的外围电子排布式为______________。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______________。
(3)配合物A中碳原子的轨道杂化类型为_______________________。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为____________mol。
键的数目为____________mol。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图2所示,则该化合物的化学式是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X溶液中只可能含有H+、Na+、NH4+、Cu2+、Al3+、Ag+、Fe3+、CO32-、NO3-、SO42-中的一种成几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下:
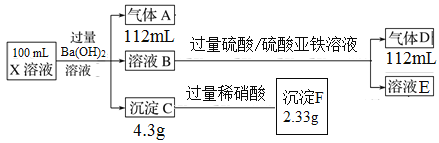
(1)X溶液中一定不存在的离子是________。
(2)加入过量H2SO4/FeSO4溶液时,发生反应的离子方程式为________。
(3)X溶液中c(CO32-)=_____mol/L,c(Na+)=______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com