
科目: 来源: 题型:
【题目】某化学兴趣小组利用还原铁粉处理含Fe(NO3)3、Cu(NO3)2、HNO3的废水,所加还原铁粉的质量与溶液中Fe2+的浓度变化关系如下图(忽略溶液体积变化)。下列有关结论错误的是( )
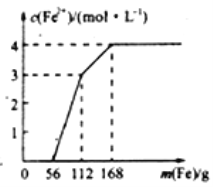
A. 加入铁粉质量小于56g时发生的反应为Fe+NO3-+4H+=Fe3++NO↑+2H2O
B. 当加入的铁粉质量超过168g后,溶液中的溶质只含有Fe(NO3)2(忽略Fe2+的水解)
C. 原废水中Fe(NO3)3的浓度为2mol/L,Cu(NO3)2的浓度均为1mol/L
D. 原废水中三种物质的氧化性由强到弱的顺序是HNO3>Fe(NO3)3>Cu(NO3)2
查看答案和解析>>
科目: 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________;
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_______________________________________;
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =__________________;
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:![]() (aq)+I2(aq)+2OH(aq)
(aq)+I2(aq)+2OH(aq)![]()
![]() (aq)+2I(aq)+ H2O(l)。溶液中c(
(aq)+2I(aq)+ H2O(l)。溶液中c(![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
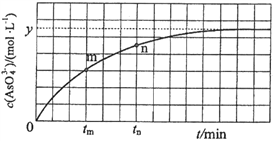
①下列不可判断反应达到平衡的是__________(填标号);
a.溶液的pH不再变化 b.v(I)=2v(![]() )
)
c.c(![]() )/c(
)/c(![]() )不再变化 d.c(I)=y mol·L1
)不再变化 d.c(I)=y mol·L1
②tm时,v逆_____ v正(填“大于”“小于”或“等于”);
③tn时v逆_____ tm时v逆(填“大于”“小于”或“等于”);
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________;
(5)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图- 1和图- 2所示:
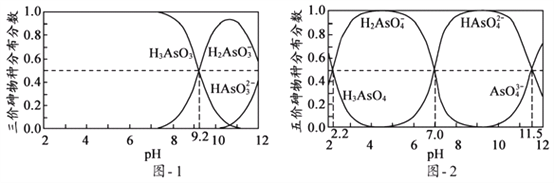
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____________;
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 );
H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 );
查看答案和解析>>
科目: 来源: 题型:
【题目】最近,我国某物理研究所取得重大科技成果,研制出由18O所构成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是
A. 1.8 g 18O2的物质的量是0.05 mol
B. 0.1 mol H218O中所含的中子数约为6.02×1023
C. 0.2 mol 18O2的体积约为4.48 L
D. 18O2的摩尔质量为36 g·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O4·2H2O,淡黄色)受热分解的部分产物。下列说法正确的是( )
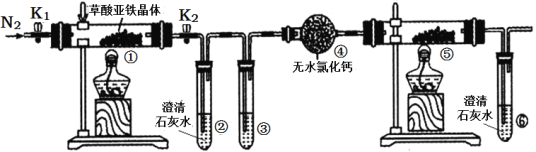
A. 通入N2的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若③和⑤中分别盛放足量NaOH溶液、CuO固体,可检验生成的CO
C. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
D. 若将④中的无水CaC12换成无水硫酸铜可检验分解生成的水蒸气
查看答案和解析>>
科目: 来源: 题型:
【题目】今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变)
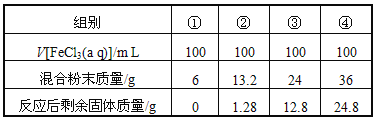
有关说法不正确的是( )
A. 第①组溶液中c(Fe3+)=2.0 mol/L
B. 第②组剩余固体只有铜
C. 第③④组反应后的滤液中c(Fe2+)=6 mol/L
D. 原混合粉末中n(Fe):n(Cu)=11:9
查看答案和解析>>
科目: 来源: 题型:
【题目】在a、b、c、d四个集气瓶中分别盛有H2、Cl2、HCl、HBr中的任一种气体,若将a和d两瓶气体混合后见光爆炸;若将a和b两瓶气体混合后,瓶壁上出现暗红色液滴,则a、b、c、d四个集气瓶中分别盛放的气体是( )
A.Cl2、H2、HCl、HBr B.Cl2、HCl、HBr、H2
C.Cl2、HBr、H2、HCl D.Cl2、HBr、HCl、H2
查看答案和解析>>
科目: 来源: 题型:
【题目】萜类化合物a、b、c广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
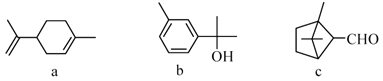
A. b和c互为同分异构体
B. a、b、c分子中所有碳原子不可能处于同一平面上
C. a、b和c均能使溴的四氯化碳溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语不正确的是( )
A. 质子数为8、中子数为10的氧原子:![]()
B. 比例模型![]() , 不能表示二氧化碳,可以表示水分子
, 不能表示二氧化碳,可以表示水分子
C. 碳正离子(CH3+)的电子式为 ![]()
D. 氨气溶于水使溶液呈碱性:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4+ + OH-
NH4+ + OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】某纯碱样品中含有少量NaHCO3杂质,现用如图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:

①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为m1g;
③准确称得m2g纯碱样品放入容器b中;
④打开仪器a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为m3g 。
⑥根据所得数据计算。试回答:
(1)仪器a的名称是___________
(2)装置B中发生反应的离子方程式_____________________________________。
(3)步骤⑤鼓入空气的目的是__________________________________________________。
(4)装置A中试剂X应选用______
A 、NaOH B、浓H2SO4 C、NaHCO3 D、NaCl
(5)如果将a的硫酸换成浓度相同的盐酸,则会导致测定结果______(“偏大”或“偏小”“不变”)
(6)如果除纯碱样品外,没有其他试剂,请设计一个也能测定纯碱样品中Na2CO3的质量分数的实验方案。主要步骤(不需要具体操作)_________________________有关化学方程式_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组同学欲利用CuO与NH3的反应来研究NH3的某种性质并测定其组成,设计的实验装置如图所示(夹持装置已省略)。
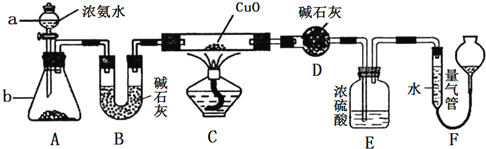
请回答下列问题:
(1)仪器a的名称为______________;仪器b中盛装的试剂为__________________(填名称)。
(2)实验中观察到装置C中黑色CuO粉末变为单质铜,且量气管中有气体单质产生,上述实验现象证明NH3具有____________性,写出相应的化学方程式:_________________________。
(3)装置E中浓硫酸的作用是_________________________________。
(4)实验结束后,若测得干燥管D增重mg,装置F中气体的体积为nL(已折算为标准状况),则氨分子中氮、氢的原子个数比为___________(用含m、n的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com