
科目: 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,下列有关R、W、X、 Y、Z五种元素的叙述中,正确的是( )
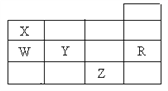
A. 通常情况下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的电负性比X的的电负性大
D. 第一电离能:R>W>Y
查看答案和解析>>
科目: 来源: 题型:
【题目】甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
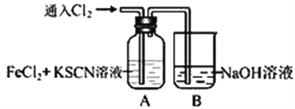
(1)B中反应的离子方程式是________________________________________________。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验。取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在__________________。
(3)资料显示:SCN -的电子式为 ![]() 。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
②甲同学通过实验证明了SCN―中氮元素转化为NO3― ,已知SCN―中碳元素没有被氧化,若SCN―与Cl2反应生成0.5mol CO2,则转移电子的物质的量是_______________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)有以下几种物质①干燥的食盐晶体 ②液态氯化氢 ③Cu ④蔗糖 ⑤NH3 ⑥KNO3溶液 ⑦CO2 ⑧熔融的KCl ⑨石墨。填空回答(填序号):以上物质中能导电的是______________;属于电解质的是__________;属于非电解质的是______________;
(2)用“双线桥”表示出反应中电子转移的方向和数目:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O_______
(3)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐为重要化合物。高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①假设用酸性高锰酸钾溶液吸收煤燃烧产生的SO2,该过程中高锰酸根被还原为Mn2+,请写出该过程的离子方程式______________。
②将燃煤产生的二氧化碳加以回收,可降低碳的排放。左图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图,a电极名称:_____________(填“正极”或“负极”),b电极的反应式:________________________。

(2)如果采用NaClO、Ca(ClO)2作吸收剂,也能得到较好的烟气脱硫效果。
已知下列反应:
SO2(g)+2OH-(aq) ==SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq) ==SO42-(aq)+Cl-(aq) ΔH2
CaSO4(s)==Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO-(aq) +2OH-(aq) = CaSO4(s) +H2O(l) +Cl-(aq)的ΔH=_____。
II.(3)FeO42-在水溶液中的存在形态如图所示。

①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是__________。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,_________转化为_________(填微粒符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的ⅥB族,F的基态原子中有4个未成对电子。
(1)A元素单质的结构式为___________;B元素原子中的未成对电子数为_______________________。
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是______;A与B形成的AB2-的空间构型为___________________________。
(3)A、B、C三种元素的第一电离能从大到小的顺序为_______________(用元素符号表示)。
(4)基态F3+的核外电子排布式是_____________________;F3+与SCN-络合得到多种配合物,其中配位数为5的配合物的化学式为__________________;化合物FD3是棕色固体、易潮解,100℃左右时升华,FD3的晶体类型是__________________________。
(5)铁在不同温度范围有不同的晶体结构。室温下铁是简单立方,称为α铁(α-Fe)。当温度升高到912℃,α铁转变为面心立方,称为γ铁(γ-Fe)。当温度继续升高到1394 ℃,γ铁转变为体心立方。称为δ铁(δ-Fe)。

①γ铁晶体中铁原子配位数是____________________。
②δ铁晶体密度为dg·cm-3,则其晶胞参数(边长)为__________cm(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于各实验装置及其使用的叙述中,正确的是(部分装置未画出)( )
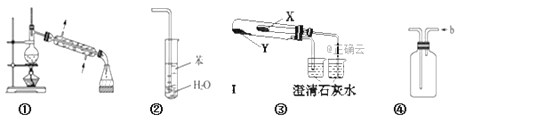
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3,并防止倒吸
C. 利用装置③验证KHCO3和K2CO3的热稳定性,X中应放的物质是KHCO3
D. 装置④ b口进气可收集Cl2、NO等气体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. 铵态氮肥不能与碱性肥料混合施用
B. 液氨可用作致冷剂
C. O2、H2S、SO2、H2均能用浓硫酸干燥,且常温能共存
D. 过量的SO2可使紫色石蕊溶液变红,但不褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,回答相关的问题。
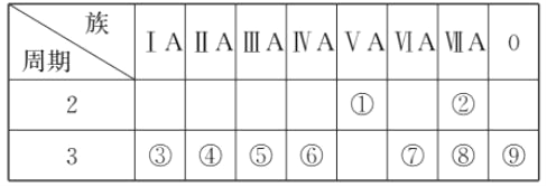
(1)写出④的元素符号________。
(2)在这些元素中,最活泼的金属元素与水反应的离子方程式:___________________________。
(3)在这些元素中,最高价氧化物的水化物酸性最强的是________(填相应化学式,下同),碱性最强的是________。
(4)这些元素中(除⑨外),原子半径最小的是________(填元素符号,下同),原子半径最大的是________。
(5)②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2 , (O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示) _____________________________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列有关叙述错误的是( )
A. 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA
B. 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个
C. 16 g CH4与18 g NH4+ 所含电子数均为10NA
D. 溶液中含氯化铁1mol,完全转化为氢氧化铁胶体后,胶粒数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com