
科目: 来源: 题型:
【题目】甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法不正确的是( )
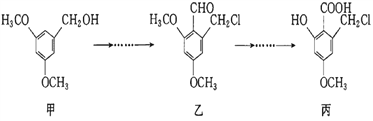
A. 乙、丙都能发生银镜反应
B. 可用FeCl3溶液鉴别甲、丙两种有机化合物
C. 甲分子中所有碳原子可能共平面
D. 乙、丙两种有机化合物均可与NaOH溶液发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,不正确的是
A. 某特定反应的平衡常数仅是温度的函数
B. 催化剂不能改变平衡常数的大小
C. 平衡常数发生变化,化学平衡必定发生移动,达到新的平衡
D. 化学平衡发生移动,平衡常数必发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到化学平衡的标志是( )
2AB(g)达到化学平衡的标志是( )
A. 容器内A2、B2、AB三种气体的浓度相等
B. 单位时间内有xmol A2生成,同时就有xmol B2生成
C. 单位时间内有xmol A2被消耗,同时就有2xmol AB生成
D. 单位时间内有xmol B2发生反应,同时就有2xmol AB被分解
查看答案和解析>>
科目: 来源: 题型:
【题目】为了减少钢管因锈蚀造成的损失,某城市拟用如图方法保护埋在酸性土壤中的钢管。下列有关说法错误的是( )

A. 在潮湿的酸性土壤中钢管主要发生析氢腐蚀
B. 在潮湿的酸性土壤中金属棒M将电子通过导线流向钢管
C. 在潮湿的酸性士壤中H+向金属棒M移动,抑制H+与铁的反应
D. 该方法称为牺牲阳极的阴极保护法
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)与CO互为等电子体的分子和离子分别为______和______。
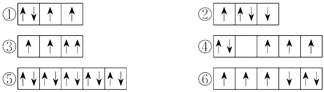
(2)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
(3)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(4)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组设计了如下装置对焦炭还原二氧化硅气体产物的成分进行探究。
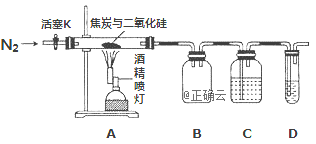
已知:PdCl2溶液可用于检验CO,反应的化学方程式为: CO+PdCl2 + H2O = CO2 +2HCl + Pd↓(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是________
(2)装置B的作用是________
(3)装置C中所盛试剂应为___________
(4)该装置的缺点是________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某铅蓄电池的正、负极标记被磨损,试用如图装置设计实验,识别出此铅蓄电池的正、负极。
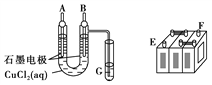
①若A接E,B接F,而B电极出现____________现象,电极反应式为_______________,则说明F为正极。
②铅蓄电池工作时(放电),其E所在电极的电极反应式为 ________,充电时该极与外接电源的________极相连。
③若有0.2 mol电子发生转移,则正极消耗的PbO2的物质的量是________。
(2)利用甲醇(CH3OH)、氧气组成燃料电池,电解质溶液为碱性,电池工作时,其负极反应式为________________________________________________________________________
(3)一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O===CH3COOH+4H+,正极的反应式:_____________________________;电池反应的总方程式为____________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.下列混合物的分离或提纯,应选用下述方法的哪一种?________(填序号)
A.分液 B.过滤 C.萃取 D.蒸馏 E.蒸发结晶 F.灼热氧化 G.加热分解
① 分离CC14和H2O_______ ② 从碘水中提取碘________
③ 分离酒精和水的混合物______ ④ 除去NaCl中所含的少量KNO3________
⑤ 除去澄清石灰水中悬浮的CaCO3__________⑥ 分离固体NH4Cl和NaCl________
Ⅱ. 现实验室需用质量分数为98%、密度为1.84g.cm﹣3的浓硫酸的体积配制450 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:①胶头滴管,②烧瓶,③烧杯,④药匙,⑤量筒,⑥托盘天平。
请回答下列问题:
(1)盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的B和__________(填字母)。

(2)配制稀硫酸时,还缺少的仪器有________(写仪器名称)。
(3)经计算,配制450 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_______mL。
(4)对所配制的稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的原因__________(填序号)。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③将稀释后的稀硫酸立即转入容量瓶后,立即进行后面的实验操作
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,又补充几滴水至刻度处
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极,e、f是小试管。通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体。
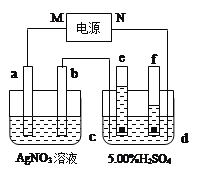
请回答下列问题:
(1)直流电源中,M为_______极。
(2)Pt电极上生成的物质是_______,其质量为______g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:__________。
(4)AgNO3溶液的浓度________(填增大、减小或不变。下同),H2SO4溶液的pH_________。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com