
科目: 来源: 题型:
【题目】A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:
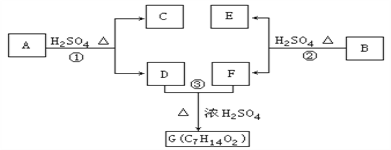
(1)化合物C的分子式是C7H8O,C遇到FeCl3溶液显示紫色,C与溴水反应生成的一溴代物只有两种,则C的结构简式为__________________;
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为_____________,D具有的官能团是________________;
(3)反应①的化学方程式是_____________________________;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是______________________________;
(5)E可能的结构简式是______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将含有C、H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。经质谱法测得该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗O2的质量是多少______?
(2)求此化合物的分子式______。
(3)经红外光谱分析,该化合物分子中存在苯环和羟基,试写出其可能的结构简式______。
(4)进一步实验表明,该化合物的核磁共振氢谱存在四个峰,且峰面积之比为1:2:2:3,试确定该化合物的结构简式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】从物质A开始有如下图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题:
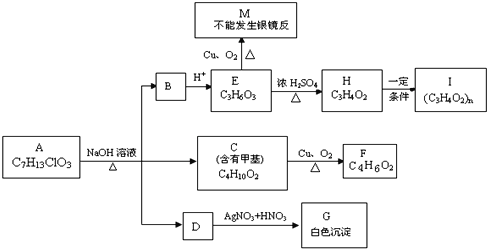
(1)A可能的结构简式:_______________________________________________;
(2)写出反应类型: E→H_________________、H→I__________________;
(3)写出C→F的化学方程式:__________________________。
(4)请设计出由丙烯合成CH3-CH(OH)-COOH的反应流程图_______(有机物用结构简式表示,必须注明反应条件)。提示:合成过程中无机试剂任选。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是
A. 浓硝酸保存在棕色玻璃试剂瓶中,且要用橡胶塞密封好。
B. 少量的钠保存在煤油中
C. 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中
D. 新制的氯水通常保存在棕色玻璃试剂瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】在有过氧化物存在的条件下,不对称烯烃与HBr加成的反应规律是溴原子加在含氢较多的碳原子上,如: CH3—CH=CH2 + HBr![]() CH3CH2CH2Br。现有分子式为C8H13O2Cl的酯A,在一定条件下发生如下图所示的一系列变化:
CH3CH2CH2Br。现有分子式为C8H13O2Cl的酯A,在一定条件下发生如下图所示的一系列变化:
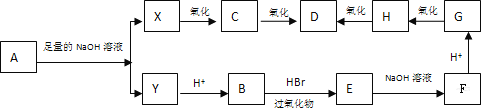
已知:A分子中不含甲基,试回答下列问题:
(1)写出下列物质的结构简式:Y____________、D___________。
(2)写出下列反应的化学方程式:
①A和足量NaOH溶液共热________________________________________;
②B→E ______________________________________________________________;
③X→C ______________________________________________________________;
④X与D发生缩聚反应:_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2 L密闭容器中进行反应:pZ(g)+qQ(g) ![]() mX(g)+nY(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
mX(g)+nY(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
物质 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3 min末/mol | 0.8 |
已知:2 min内v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
请回答下列问题:
(1)2 min内X的反应速率v(X)=__________。
(2)起始时n(Y)=__________。
(3) 3 min末是否达到平衡_______(填是或否)。
(4)对于该反应,能增大正反应速率的措施是________(填序号,下同)。
A.缩小容器体积 B.移走部分Q
C.通入大量He气 D.升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】已知氯气与NaOH溶液反应可生成NaCl、NaClO、NaClO3,NaClO在加热条件下分解生成NaCl和NaClO3,现向氢氧化钠溶液中通入一定量的氯气,加热少许时间后溶液中形成混合体系。下列判断不正确的是( )
A. 若反应过程中消耗1 mol氯气,则1 mol<转移电子数<![]() mol
mol
B. 反应停止后n(NaClO)∶n(NaCl)∶n(NaClO3)(物质的量之比)可能为1∶11∶2
C. 反应过程中消耗氯气与NaOH的物质的量之比为1∶2
D. 氧化产物为NaClO和NaClO3,反应过程中n(NaClO)∶n(NaClO3)为1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】有关核外电子运动规律的描述错误的是
A. 处于最低能量的原子叫做基态原子
B. 核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释
C. 3p2表示3p能级有两个轨道
D. 在电子云示意图中,小黑点密表示电子在核外空间单位体积内出现的机率大
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是( )
A. 常温常压下,20.0 g重水(D2O)所含的中子数约为6.02×1023
B. 室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C. 通常状况下,1 mol的NO2与N2O4混合气体变为标准状况时其分子数约为6.02×1023
D. 常温下,7.1 g Cl2与足量NaOH溶液反应转移的电子数约为0.2×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com