
科目: 来源: 题型:
【题目】将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol·L-1 的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A. 开始加入合金的质量可能为16.4g
B. 标准状况下产物NO的体积为22.4L
C. 生成沉淀完全时消耗NaOH溶液的体积为100mL
D. 参加反应的硝酸的物质的量为0.1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意完成下列问题:
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:_______________________________________。
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①则从反应开始到20mi时,以NO表示的平均反应速率= ________,该温度下该反应的平衡常数K=____(保留两位小数)
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_____(写一条即可)。
③下列描述中能说明上述反应已达平衡的是__________;
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为_______________
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________________________,电池总反应式为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。其制备方法有:
(1)方法一:用氯酸钠(NaClO3)和硫酸酸化的H2O2反应生成ClO2。请写出该反应的化学方程式___________________________________________。
(2)方法二:用氯酸钠氧化浓盐酸,生成二氧化氯的同时会有氯气产生。请写出该反应的化学方程式_____________________________________。
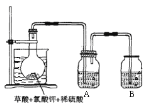
(3)方法三、
①如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),
然后再加入足量的稀硫酸,水浴加热。反应后产物中有
ClO2、CO2和一种酸式盐,该反应的化学方程式为:__________________________________,
氧化产物与还原产物的物质的量之比为____________。
②控制水浴温度在60~80℃之间的目的是_______________________,
图示装置中缺少的一种必须的玻璃仪器是____________。
③A装置用于吸收产生的二氧化氯,其中最好盛放________。(填序号)①60 ℃的温水 ②冰水 ③饱和食盐水
④将足量二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的离子方程式_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物。合成其的两种中间体及羟甲香豆素的结构如下:
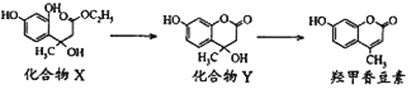
下列有关说法正确的是
A. 化合物X和Y分子各含有2个手性碳原子
B. 化合物Y能发生加成反应、取代反应和消去反应
C. lmol 羟甲香豆素最多可与2moINaOH反应
D. 化合物X和羟甲香豆素分别与溴水反应,最多消耗的Br2的物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是![]()
![]()
A. 向含2molFeBr2的溶液中通入2molCl2:2Fe2++Cl2═2Cl-+2Fe3+
B. 向2molNaAlO2溶液中滴加5molHCl溶于水中:2AlO2- + 5H+ = Al3+ + Al(OH)3↓+ H2O
C. 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O
D. 往氢氧化钠溶液中通入少量SO2与水反应OH- + SO2 = HSO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,VL氨气溶解在1L水中(水的密度近似为lg/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ρ=![]() B. ω=
B. ω=![]() C. ω=
C. ω=![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】对于铵盐的描述都正确的是( )
①都溶于水 ②都是白色晶体 ③都有刺激性气味 ④加热后都有氨气放出 ⑤与碱混合后加热都有氨气放出 ⑥都能使湿润的红色石蕊试纸变蓝
A.全部
B.①②⑤⑥
C.①②⑤
D.③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中所示物质或概念间的从属关系符合下圈的是
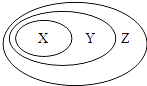
X | Y | Z | |
A | 钠元素 | 主族元素 | 短周期元素 |
B | 电解质 | 化合物 | 纯净物 |
C | 氢氧化铁 | 分散系 | 胶体 |
D | 置换反应 | 氧化还原反应 | 放热反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种重要的化工原料,其有关制备途径及性质如图所示下列说法正确的是
是一种重要的化工原料,其有关制备途径及性质如图所示下列说法正确的是
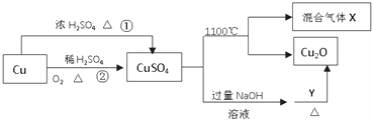
A. 相对于途径①,途径②更好地体现了绿色化学思想
B. 加Y加热过程中,Y被还原
C. CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体。
D. 将CuSO4溶液蒸干,可制得胆矾晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种消毒杀菌剂,实验室可通过下列反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是![]()
![]()
A. KClO3在反应中得到电子B. ClO2是氧化产物
C. H2C2O4被还原D. 1molKClO3发生反应,转移的电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com