
科目: 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。已知,能量密度=电池输出电能/燃料质量(已知电子的电荷量为1.6×10-19C),以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是

A. 每消耗2.24 L O2(标准状况)时,A电极的质量减轻12.8 g
B. 离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
C. 该燃料电池的负极反应式为BH4-+8OH--8e-=BO2- + 6H2O
D. 若NaBH4 燃料电池的电压为U伏,则此电池的能量密度为2.03×104UkJ·kg-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某第三周期元素X的气态氢化物的化学式为XH3,则X的最高价氧化物的水化物的化学式为( )
A. H2XO3 B. HXO3 C. H3XO4 D. H2XO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是( )
A.利用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体
B.只能利用焰色反应可鉴别KCl溶液和Na2SO4溶液
C.用润湿的pH试纸测量某溶液的pH
D.实验室用NaOH溶液除去CO2中的少量HCl气体
查看答案和解析>>
科目: 来源: 题型:
【题目】两种微粒的核外电子数相同,核电荷数不同,则它们可能是( )
A. 两种不同的离子 B. 两种元素的不同原子
C. 同种元素的原子和离子 D. 两种不同元素的分子
查看答案和解析>>
科目: 来源: 题型:
【题目】雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。
(1)元素第一电离能:Al______Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: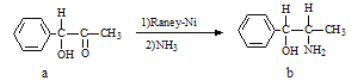 化合物b中进行sp3杂化的原子有__________个。
化合物b中进行sp3杂化的原子有__________个。
(3)一种铝镍合金的晶胞结构如下图,与其晶胞结构相似的化合物是____________(选填序号)。
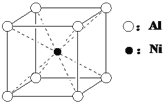
a.氯化钠 b.氯化铯 c.石英 d.金刚石
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
①Ni2+在基态时,核外电子排布式为____________________。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)______。
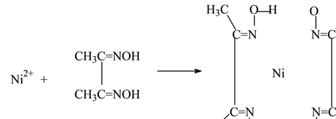
查看答案和解析>>
科目: 来源: 题型:
【题目】在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】铝及其化合物广泛应用于金属冶炼和有机合成等领域。
(1)铝热反应可以冶炼金属铬,基态铬原子的核外电子排布式为:_______________________。
(2)AlCl3可用作下列反应的催化剂

①乙酸酐分子中发生sp3杂化的原子共有______个
②CH3COOH和H2O可以以任意比例互溶,其原因是它们均是极性分子和_________________。
③单个AlCl3分子的空间构型为_______。
(3)在氧化铝的作用下,N4H4(SO4)2可同碱反应生成一种类似白磷的N4分子,1molN4分子中含有的共价键的物质的量为_____mol
(4)某遮光剂的晶胞如图甲(黑球为Na+,白球为AlFn(n-3)-阴离子),由图可推算知,n=________。

(5)由Fe和Y形成的某化合物的晶胞如图乙所示,该晶胞中与亚铁离子距离相等并且最近的亚铁离子有_____个。 另有一种有缺陷的Fe和Y形成的化合物的晶体由Fe2+,Fe3+,Y2-及空隙组成,可表示为Fe0.98Y,则该晶体中,n(Fe2+) : n(Fe3+) =______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的核外电子排布式为___________,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________,与其为等电子体的分子是___________
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。
(3)单质铜及镍都是由____键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol–1,ICu> INi的原因是______________________。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为____________。
②若合金的密度为d g·cm–3,晶胞参数a=__________nm。
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+ 配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3和NH3键角不同,其中键角较大的是____________,其原因是_______________________。且NF3不易与Cu2+形成配离子,其原因是:_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com