
科目: 来源: 题型:
【题目】我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示为下图所示
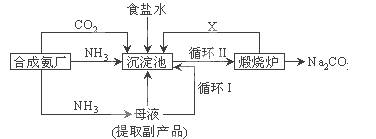
(1)侯氏制碱法又称___________,副产品的一种用途为____________ .
(2)写出上述流程中 X 物质的分子式________。
(3)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水中,再滴加_________。
(4)请简述与索尔维法相比,侯氏制碱法的优点:____。
(5)如图是在实验室中模拟“氨碱法”制取 NaHCO3 的部分装置。
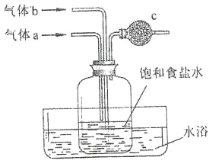
完成下列填空:
仔细观察两只通气导管内所处的位置,由此推断:
气体 a 为_____,气体 b 为_________;两者的通入次序为_____。 为防止尾气污染,c 中可放入蘸_____溶液的脱脂棉。
(6)气体 a 与 b 均可用如图装置进行制备。 当锥形瓶中固体为生石灰时,分液漏斗中应盛放_________。 用该装置制备另一种气体的方法是:_____(用离子方程式表示)。
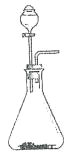
(7)反应过程中可以看到装置饱和食盐水中有晶体逐渐析出,写出相关反应的化学方程式:________。
(8)反应过程中采用水浴加热,其优势是_____。
水浴温度维持在 42℃左右,温度过低,反应速率太慢,不利于晶体析出;温度过高,_____,也不利于晶体析出。
(9)反应结束后,将热水浴换成冰水浴,冷却 15min 左右再进行过滤,目的是:_________。
(10)得到的 NaHCO3 晶体中会含有少量 NaCl 杂质,可采用如下方法进行纯度测定:
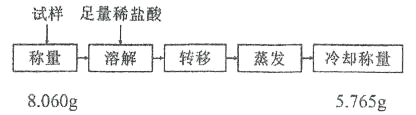
该试样中 NaHCO3 的质量分数为_____(精确到 0.01)。若称量操作无误,但最终测定结果的相对误差为 1.5%,写出可能导致该结果的一种情况:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A. 毒胶囊和老酸奶事件说明化学试剂对食品的危害,我们应该拒绝一切化学试剂的使用
B. 兴建更多的钢铁、水泥企业,提高钢铁、水泥的产量
C. 日本核泄漏造成的核辐射事故暴露出核能应用潜在的巨大危险,应立即停建核电站
D. 开发新能源,减小含碳化合物的使用,降低碳的排放
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始容积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断不正确的是

A. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
B. 该反应的化学方程式为3Z ![]() 3X+2Y
3X+2Y
C. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
D. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固体或液体
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,将a L H2和Cl2的混合气体点燃,充分反应后,将混合气体通入含b mol NaOH的热溶液中,气体恰好被吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO3-,则原混合气体中H2的物质的量为
A. a/2 molB. (a/22.4-b) molC. (a/22.4-b/2) molD. b/2 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】今将Fe16.8g加入到1L浓度为nmol/L的稀硝酸溶液中(假定硝酸还原产物只NO)充分反应后,Fe和HNO3均无剩余,n不可能为
A. 0.6B. 0.8C. 1.0D. 1.2
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气脱硝脱碳主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) +Q(Q>0)。一定条件下密闭容器
N2(g)+2CO2(g) +Q(Q>0)。一定条件下密闭容器
中,用传感器测得该反应在不同时间 NO 和 CO 浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/molL-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-3 | 1.50×10-3 | 1.50×10-3 |
c(CO)/molL-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
完成下列填空:
(1) 写出该反应的平衡常数表达式:_________。 温度升高,二氧化碳气体的浓度将______(填“变大”、“变小”或“不变”)。
(2)前 2s 内的氮气的平均反应速率是:v(N2)=______mol/(Ls);达到平衡时,CO 的转化率为:_____。
(3)工业上常采用“ 低温臭氧氧化脱硫脱硝” 技术来同时吸收 SO2 和氮的氧化物气体(NOx ),以获得(NH4)2SO4 的稀溶液。在此溶液中,水的电离程度是受到了_____(填“促进”、“抑制”或“没有影响”);
若往(NH4)2SO4溶液中再加入少量稀盐酸,则![]() 值将_____(填“变大”、“变小”或“不变”)。
值将_____(填“变大”、“变小”或“不变”)。
(4)如果向 BaCl2 溶液中通入足量 SO2 气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用平衡移动原理解释上述现象:___________________________。
(5)向另一种可溶性钡盐溶液中通入少量 SO2 气体,会立即看到白色沉淀。该沉淀的化学式为_____; 原可溶性钡盐可能是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示五层膜材料常用于汽车玻璃中的电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是( )

A. 当B外接电源负极时,膜的透射率降低,可以有效阻挡阳光
B. 当A接电源的正极时,此时Li+脱离离子存储层
C. 当B外接电源正极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
D. 该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型镁储备电池的储存寿命长,电压平稳,电池的总反应为Mg+Cu2Cl2=2Cu+MgCl2,以该电池为电源在铜片上镀银的实验装置如图所示。
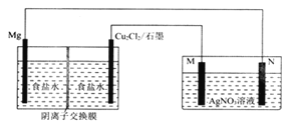
下列说法正确的是
A. 若反应消耗1mol Mg,则有1mol Cl-通过阴离子交换膜
B. M电极材料为铜片
C. 接通电路后,电池的正极质量减小
D. 接通电路后,AgNO3溶液的浓度减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电化学装置的说法正确的是
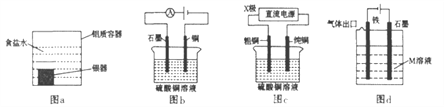
A. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
B. 图c中的X极若为负极,则该装置可实现粗铜的精炼
C. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
D. 利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-= 2Ag+S2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com