
科目: 来源: 题型:
【题目】Ⅰ.(1)某短周期元素组成的分子的球棍模型如图所示。已知分子中所有原子的最外层均达到8电子稳定结
构,原子间以单键相连。下列有关说法中错误的是(________)
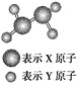
A.X原子可能为ⅤA族元素
B.Y原子一定为ⅠA族元素
C.该分子中,既含极性键,又含非极性键
D.从圆球的大小分析,该分子可能为N2F4
(2)若上述模型中Y原子最外层达到2电子稳定结构且其相对分子质量与O2相同,则该物质的分子式为______________,它与P2H4常温下均为气体,但比P2H4易液化,常用作火箭燃料,其主要原因是______________________________________________________________________。
Ⅱ.已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键,试推断:
(1)X、Z两种元素的元素符号:X___________________________________________、
Z______________________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________,它的共价键属于________(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为________;含有极性共价键和非极性共价键的化合物的电子式为________________________________。
(3)由X、Y、Z所形成的常见离子化合物是__________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___________________________________________________________________________________________;
X与W形成的化合物与水反应时,水是_____________________________________
(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z的过程: __________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列变化中属于吸热反应的是
①液态水汽化 ②碳酸钙分解 ③苛性钠固体溶于水 ④C与H2O制水煤气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A. ①②④B. ②④C. ③⑤D. ①②④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】关于元素周期表中元素分布的描述,正确的是
A. 周期表中的主族都有非金属元素
B. 周期表中的主族都有金属元素
C. 周期表中的金属元素都位于长周期
D. 周期表中的非金属元素都位于主族和0族
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)CO和NO2是汽车尾气的主要污染物.汽车尾气的反应式之一为:2NO(g)+2CO(g)═N2(g)+2CO2(g).请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
2C(s)+O2═2CO(g)△H=﹣221kJ/mol
则2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=______.
(2)一定温度下,在一体积为VL的密闭容器中充入一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=a mol、n(NO)=2a mol、n(N2)=b mol,且N2占平衡混合气体总价体积的1/4.
①该反应的平衡常数K=______(用只含a、V的式子表示)
②判断该反应达到平衡的标志是______(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(3)在一定温度下,将2.0mol NO、2.4mol CO通入固定容积2L的密闭容器中,反应过程中部分物质的物质的量变化如图一所示,

则①有害气体NO的转化率是______,0~15min CO2的平均反应速率v(CO2)=______②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是______(填序号)
A.增加CO2的量 B.加入催化剂 C.降低温度 D.扩大容积体积
(4)通过NOX传感器可监测NOX的含量,其工作原理如图二所示,
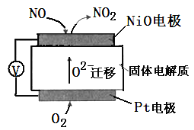
则①Pt电极上发生的是______反应(填“氧化”或“还原”)②NiO电极上的电极反应式为______.
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 0.1 mol·L-1CH3COONa溶液和0.1 mol·L-1 HCl溶液等体积混合:
c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B. 0.1 mol·L-1 NH4Cl溶液和0.1 mol·L-1 氨水等体积混合(pH>7):
c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C. 0.1 mol·L-1 Na2CO3溶液和0.1 mol·L-1 NaHCO3溶液等体积混合:
![]() c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
D. 0.1 mol·L-1 Na2C2O4溶液和0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
![]()
试回答:
(1)若X是强氧化性气体单质,则A可能是______(填序号)。
a.C b.Al c.Na d.Mg
(2) 若A、B、C均为含有同种金属元素的化合物,且A为氧化物,反应①中X是强碱,反应②中X为CO2,则C的化学式为_________,反应②的离子方程式____________________,反应②中CO2_______(填“能”或“否”)用盐酸或稀硫酸代替.
(3) 若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在A中燃烧产生棕黄色的烟。B的化学式为________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)____________________________;检验此C溶液中金属元素的操作方法是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+ O2 (g)![]() 2SO3(g),其正反应放热。现有三个体积相同的密闭容器
2SO3(g),其正反应放热。现有三个体积相同的密闭容器
I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A. 容器I、III中平衡常数相同
B. 容器II、III中正反应速率相同
C. 容器II、III中的反应达平衡时, SO3的体积分数:II > III
D. 容器I中SO2的转化率与容器II中SO3的转化率之和小于1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 反应N2 (g) +3H2 (g) ![]() 2NH3 (g)的ΔH < 0,ΔS >0
2NH3 (g)的ΔH < 0,ΔS >0
B. 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
C. 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol·L-1
D. 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】(15分)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应).
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为 ,K的原子结构示意图为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A. 氨水稀释后,溶液中![]() 的值减小
的值减小
B. 0.1 mol·L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH增大
C. 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D. 298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com