
科目: 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

A. 原混合溶液中的CO2-3与AlO-2的物质的量之比为1:2
B. V1:V2=1:5
C. M点时生成的CO2为0.05mol
D. a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 元素周期表中,除第一和第七周期外,第n周期所含非金属元素(包括稀有气体元素)的种数均为(8-n)
B. SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构
C. M层电子数为奇数的主族元素所在族的序数与该元素原子的M层电子数不一定相等
D. 由ⅠA族和ⅥA族短周期元素形成的原子个数比为1∶1,电子总数为38的化合物,是含有共价键的离子型化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 在粗硅的制取中发生2C+SiO2![]() 2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
B. 盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C. 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D. 由Na2CO3+SiO2![]() Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
查看答案和解析>>
科目: 来源: 题型:
【题目】对实验Ⅰ~Ⅳ的实验现象预测正确的是
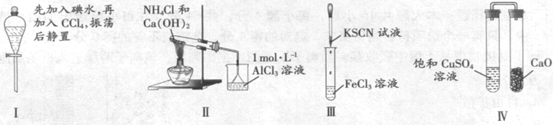
A. 实验I:液体分层,下层呈无色
B. 实验II:烧杯中先出现白色沉淀,后溶解
C. 实验III:试管中溶液颜色变为红色
D. 实验IV:放置一段时间后,饱和硫酸铜溶液中出现蓝色晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧化镁用于制药工业,还是重要的绿色阻燃剂。
I、治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2。
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式:___________。
Ⅱ、已知:Mg (s)+2H2O(g)=Mg(OH)2(s)+H2(g) △H1=-441kJ·mol-1
H2O(g)=H2(g)+![]() O2(g) △H2=+242kJ·mol-1
O2(g) △H2=+242kJ·mol-1
Mg(s)+![]() O2(g)=MgO(s) △H3=-602kJ·mol-1
O2(g)=MgO(s) △H3=-602kJ·mol-1
(2)氢氧化镁分解的热化学方程式是___________。
(3)氢氧化镁可以作为阻燃剂的原因_________。(写一条即可)
Ⅲ、某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。
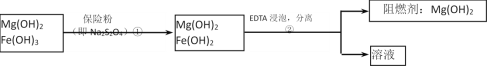
(4)步骤②中分离操作的名称是__________。
(5)步骤①中的反应如下:6Fe(OH)3 +S2O42-+2OH- =6Fe(OH)2 +2SO42-+4H2O。每消耗0.1mol保险粉(Na2S2O4)时,转移电子的数目是__________mol。
(6)已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(OH)2反应。虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2。请从沉淀溶解平衡的角度加以解释。
_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是( )
A. 向水中通入SO2 B. 将水加热煮沸
C. 向纯水中投入一小块金属钠 D. 向水中加入NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y可以形成化合物XY2,下列有关叙述不正确的是( )
A. 若XY2是共价化合物,则X与Y的原子序数可能相差1
B. 若XY2是离子化合物,则X与Y的原子序数可能相差8
C. 若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小
D. 若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】由12CO和14CO组成的混合气体对氦气的相对密度为7.125,则混合气体中12C和14C的原子个数比为( )
A. 1∶1 B. 1∶2 C. 3∶1 D. 2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com