
科目: 来源: 题型:
【题目】在200 ℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭器中,发生反应:I2(g)+H2(g)![]() 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于c(H2)=______ mol·L-1,而c(HI)=________,所以化学反应速率________最大。(填v(正)或v(逆))。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)_____,而c(HI)_____ ,从而化学反应速率v(正) _______ (填减小、增大、不变)。
(3)当反应进行到v(正)与v(逆)________时,此可逆反应达到了最大限度。若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率都将________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列能量转化过程与氧化还原反应无关的是
A. 硅太阳能电池 | B. 锂离子电池放电 | C. 火箭的燃料燃烧 | D. 葡萄糖提供能量 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,研究和合成甲醇有着重要的意义。
(1)已知:①H2(g)+1/2O2(g)![]() H2O(l) ΔH1<0;②CO2(g)
H2O(l) ΔH1<0;②CO2(g)![]() CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)
CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)![]() CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
(2)该方法生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
①下列叙述合确的是__________(填编号)。
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和容积不变,再向容器中充入0.8mol CO和0.6mol CH3OH,则此时v正>v逆
②在方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线 ___________________
(3)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应Ⅱ: CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图2所示。
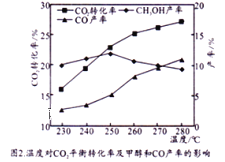
①由图2可知温度升高CO的产率上升,其主要原因可能是__________。
②由图2可知获取CH3OH最适宜的温度是_____。
(4)近几年开发的甲醇燃料电池的工作原理如图所示:
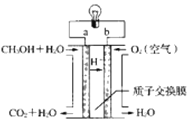
电池中的质子交换膜只允许质子和水分子通过,电解质溶液为稀硫酸,则a电极的电极反应式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科研人员在兰州合成了镤元素的一种同位素镤239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
A. 第三周期第IA族 B. 第四周期第IA族
C. 第五周期第IA族 D. 第二周期第IIA族
查看答案和解析>>
科目: 来源: 题型:
【题目】以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知: SOCl2+H2O![]() SO2↑+2HCl↑,下列说法不正确的是
SO2↑+2HCl↑,下列说法不正确的是
A. “酸浸” 时应该用盐酸溶解硅孔雀石粉
B. “氧化”时发生反应的离子方程式为:Cl2+2Fe2+![]() 2Fe3++2Cl-
2Fe3++2Cl-
C. “调pH”时,pH需控制在碱性区域,保证铁元素全部以Fe(OH)3形式除去
D. “加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现有 0.1 mol·L-1的 NH4HCO3 溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是
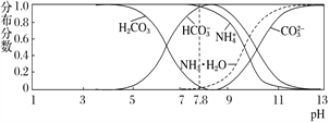
A. 当溶液的 pH=9 时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3 ·H2O)>c(CO32-)
B. NH4HCO3 溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3)
C. 往该溶液中逐滴滴加氢氧化钠时,NH4+和 HCO3-浓度均逐渐减小
D. 通过分析可知常温下 Kb(NH3·H2O)大于 Ka1(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料。添加塑化剂(DBP)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害。其合成线路图如图I所示:
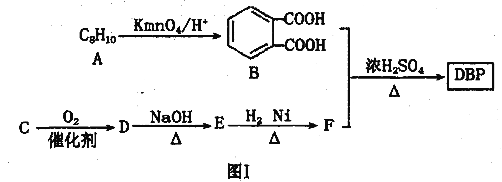
已知以下信息:
①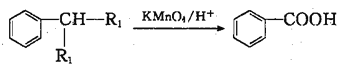
②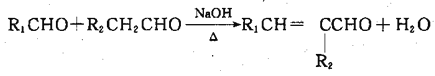 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)
③C为含两个碳原子的烃的含氧術生物,其核磁共振氢谱图如图II所示
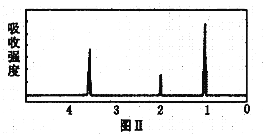
请根据以上信息回答下列问题:
(1)C的结构简式为________,E中所含官能团的名称是_________。
(2)写出下列有关反应的化学方程式:
①E和H2以物质的量比1:1反应生成F________。
②B和F以物质的量比1 :2合成DBP____________,该反应的反应类型为_________。
(3)同时符合下列条件的B的同分异构体有______种,写出其中任意一种同分异构体的结构简式________。
①不能和NaHCO3溶液反应 ②能发生银镜反应
③遇FeCl3溶液显紫色 ④核磁共振氢谱显示苯环上只有一种氢原子
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在2 L密闭容器中,X、Y、Z三种气态物质发生化学反应时,物质的量随时间变化的关系曲线如图所示:
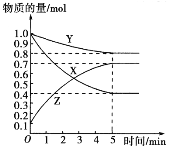
(1)由图中的数据分析,该反应的化学方程式为_________ 。
(2)5 min内用Z表示的平均反应速率为_______________。
(3)化学反应速率受到很多因素的影响,例如:实验室制取氢气时一般用粗锌代替纯锌和稀硫酸反应,这是利用_____________________原理加快了氢气生成的速率。
查看答案和解析>>
科目: 来源: 题型:
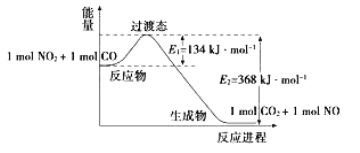
【题目】(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_______________________________________________________。
(2)总反应:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O写出下列的电极反应式
负极:_____________________________
正极:_____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com