
科目: 来源: 题型:
【题目】为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.沉淀分析法,甲组同学按如下图所示的实验流程进行实验:
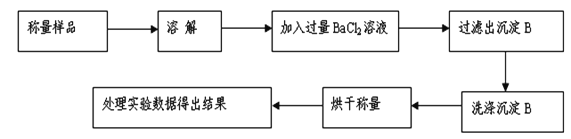
(1)实验时,过滤操作中,除了烧杯、玻璃棒外,还要用到的玻璃仪器为___________。
(2)洗涤沉淀B的操作是__________________________________。
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为____________。
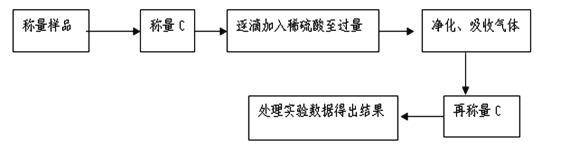
方案Ⅱ:气体分析法,乙组同学的主要实验流程图如下:
按如下图所示装置进行实验:
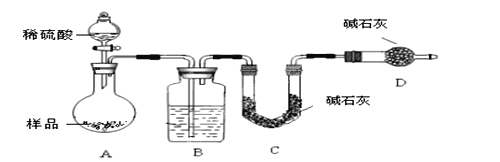
(4)该实验中装置B盛放的物质是_________________。
(5)D装置的作用是____________________________________。
(6)为减少实验误差,在反应前后都通入N2,反应后通入N2的目的是_____________________。
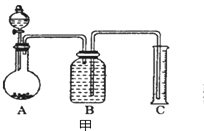
(7)把一定量样品与足量稀硫酸反应后,用如图装置测量产生CO2气体的体积,B溶液最好采用_______(以下选项中选择)使测量误差较小。
a饱和碳酸钠溶液 b饱和碳酸氢钠溶液
c饱和氢氧化钠溶液 d饱和硫酸铜溶液
(8)但选用该溶液后实验结果仍然不够准确,其原因可能是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.欲配制0.18 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案;
方案一:用托盘天平称取________g无水醋酸钠,溶于适量水中,配成500 mL溶液。定容时若仰视容量瓶刻度线,则所配制结果将___________(填“偏大”“偏小”或“无影响”)。
方案二:用体积均为250 mL且浓度均为________ mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
Ⅱ.某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
(1)写出上述反应的化学方程式______________________________
(2) NaH2PO2 为__________ (填“正盐”或“酸式盐”),
(3)已知NaH2PO2水溶液pH>7,次磷酸的电离方程式为______________________;
NaH2PO2水溶液pH>7的原因:________________________________________。
(4)H3PO2 及 NaH2PO2均可将溶液中的 Ag+ 还原为银,从而可用于化学镀银。
利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4︰1,则氧化产物为:
______________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据图的能量图,下列说法正确的是:
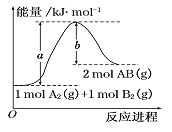
A. A2(g) + B2(g) = 2AB(g) 是一个放热反应
B. 2molAB的总能量大于1molA2和lmolB2的能量之和
C. 2AB(g) = A2(l) + B2(l) △H<(b-a)kJ/mo1
D. 1molA2(g)和1molB2(g)的能量之和为akJ
查看答案和解析>>
科目: 来源: 题型:
【题目】下列性质递变不正确的是( )
A. 酸性:HClO4>H2SO4>H3PO4 B. 半径:Cl—>Na+>F—
C. 热稳定性:HF>HCl>HBr D. 还原性:Cl—<Br—<I—
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向浓度均为0.1 mol/L 体积均为10mL的两种一元酸(HX、HY)溶液中,分别滴入0.1 mol·L-1NaOH溶液,pH的变化曲线如图所示。下列说法错误的是

A. N点:c(Na+)=c(Y- )+c(HY)
B. M点:c(X-)>c(Na+)
C. 滴至pH=7时,消耗NaOH溶液的体积:HX>HY
D. 滴入10mLNaOH溶液时,溶液中水的电离程度:HX<HY
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. 二氧化硅是一种立体网状结构的晶体,熔点高、硬度大
B. 二氧化硅为酸性氧化物,能与水化合生成硅酸
C. 实验室不能用磨口玻璃塞试剂瓶盛放氢氧化钠溶液
D. 氢氟酸能雕刻玻璃,故不能用玻璃瓶盛放氢氟酸
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下图所示:
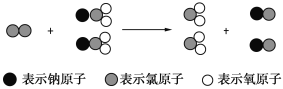
下列有关该反应的叙述中正确的是 ( )
A. 该反应是置换反应
B. 该反应的化学方程式为Cl2+NaClO2===ClO2+NaCl
C. 反应中Cl2既是氧化剂,又是还原剂
D. 氧化性: Cl2 > ClO2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1。
实验 1 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液不显红色。 |
① 写出FeCl3溶液与KI溶液反应的离子方程式_______________________。
② 加入KSCN溶液的目的是_______________________________________。
③ 甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,改进实验方案,进行实验2。
实验2 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液显红色。 | |
ⅲ. 继续加入2 mL CCl4,充分振荡、静置。 | ⅲ. 液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 |
本实验改用0.1 mol·L-1 KI溶液的目的是_________________________________________。
用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因________________。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I-![]() I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
① 为验证假设,乙同学设计并完成了实验3。
实验3 | 实验步骤 | 实验现象 |
ⅰ. 取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。 | ⅰ. 液体分层,上层呈黄色,下层呈紫红色。 | |
ⅱ. 取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。 | ⅱ. 液体分层,上层为无色,下层呈紫红色。 |
实验3的结论是_________________________________。
② 甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I-![]() I3-的存在。
I3-的存在。
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中_________________。两支试管中的现象分别为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com